Rénald Delanoue, chercheur Inserm et ses collègues de l’Institut de biologie Valrose de Nice (Inserm-CNRS-Université Côte d’Azur) ont identifié les maillons manquants du processus de régulation de la taille d’un organisme en fonction de la richesse de son alimentation. Leurs recherches ont été menées sur la drosophile, un insecte qui semble bien éloigné de l’Homme mais dont l’étude a permis de nombreuses avancées pour la recherche biomédicale. Ces travaux sont publiés dans la revue Science datée du 30 septembre 2016.
La taille d’un organisme dépend de l’apport nutritif dont il a bénéficié au cours de son développement. En cas de carence durant cette période, les animaux adaptent leur croissance et deviennent des adultes de petite taille tout en conservant des proportions harmonieuses. Ce couplage entre nutrition et croissance fait intervenir des hormones de la famille des insulines et des IGF (Insulin Growth Factor) mais les mécanismes moléculaires qui régissent cette régulation ne sont pas encore bien compris.
Le travail des chercheurs de l’Inserm au sein de l’Institut de biologie Valrose (Inserm-CNRS-UCA), a permis d’identifier les substances sur lesquelles reposent ce couplage au niveau moléculaire chez la drosophile (Drosophila melanogaster). Malgré 700 millions d’années de divergence évolutive, cet insecte est un modèle pertinent pour la recherche biomédicale car il possède les mêmes processus physiologiques que les mammifères.
Par exemple, il est intéressant de savoir que le corps gras de la drosophile remplit les mêmes fonctions que le foie et les tissus adipeux chez l’Homme. Les cellules neurosécrétrices IPC (Insulin-Producing Cells) sont situées pour leur part dans le cerveau larvaire de l’insecte et correspondent fonctionnellement aux cellules β du pancréas chez l’Homme.
Grâce au modèle de la drosophile, ces chercheurs ont déjà montré que le couplage entre nutrition et croissance nécessite une communication entre ces deux organes (ndlr corps gras et IPC). Selon la quantité d’acides aminés disponible dans l’alimentation, le corps gras envoie des signaux différents au cerveau. Les cellules IPC sont capables de les interpréter et de secréter de l’insuline en quantité appropriée. Un faible taux d’acides aminés induit une réduction de la sécrétion d’insuline et un ralentissement de la croissance et inversement.
Restait à identifier la nature de ces signaux agissant à distance, ainsi que la molécule des IPC capable de les interpréter pour déterminer la quantité d’insuline à sécréter. Pour cela les chercheurs ont inhibé un par un tous les récepteurs connus sur les IPC et identifié le récepteur Methuselah, dont l’inhibition stoppe la sécrétion d’insuline.
La protéine Stunted qui se lie à ce récepteur était connue, mais n’avait pas été associée à la régulation de la sécrétion d’insuline. Et pour cause ! Cette protéine se trouve d’habitude majoritairement à l’intérieur des cellules et joue un rôle dans la synthèse de l’ATP. Leur présence sous forme circulante dans l’hémolymphe de l’insecte (équivalent du sang) est donc une découverte surprenante. Les chercheurs ont montré que le taux de Stunted circulante varie en fonction des quantités d’acides aminés présents dans la nourriture. Sa suppression perturbe la sécrétion d’insuline et génère des adultes de petite taille. Enfin, ils ont également démontré que cette fonction « signal » de Stunted dans la communication entre deux organes est une fonction inédite et indépendante de celle liée à la synthèse de l’ATP.
Ces résultats, bien que très fondamentaux, pourraient néanmoins guider l’ étude des circuits moléculaires de certaines maladies comme le diabète, l’obésité ou certaines formes de cancers qui dépendent d’hormones et de récepteurs appartenant à la même famille que ceux décrits chez la drosophile. Les protéines Stunted, qui ont été repérées à la surface de nombreux types de cellules, pourraient jouer également un rôle de signal chez l’homme.
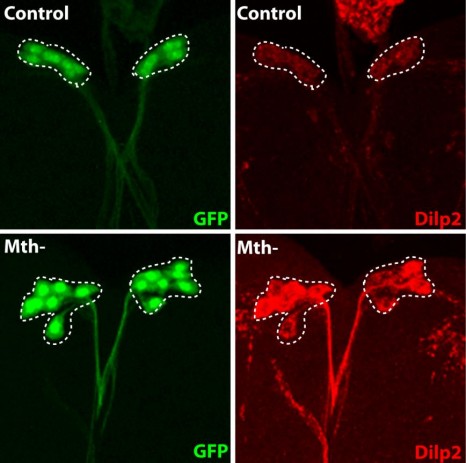
La protéine fluorescente GFP (en vert) est exprimée dans les neurones producteurs d’insuline, les IPC (traits pointillés blanc). La sécrétion des insulines de Drosophile (Dilp2, en rouge) est régulée dans ces neurones spécialisés par la présence du récepteur Methuselah. L’absence de cette protéine membranaire dans les IPC (Mth-) entraîne un blocage de sécrétion et l’accumulation de l’insuline (Dilp2) dans les IPC (ligne du bas), par rapport au contrôle (ligne du haut). Crédit photo : Renald Delanoue/Inserm