11 ans déjà ! En mars 1999, Alain Fischer, Marina Cavazzana-Calvo et Salima Hacein- Bey-Abina et leurs équipes de l’Inserm, de l’AP-HP et de l’Université Paris Descartes traitaient pour la première fois par thérapie génique des enfants atteints d’une maladie les privant de défenses immunitaires. Aujourd’hui, sept enfants pris en charge en France vont bien et mènent une vie normale. Ces onze années ont permis aux chercheurs de perfectionner la thérapie, de comprendre et de tenter de s’affranchir des problèmes de toxicité rencontrés aux débuts de cette aventure. En écho à cette réussite, deux nouveaux essais cliniques démarrent en 2010. Ils concernent le DICS-X et le syndrome de Wiskott Aldrich. Le suivi de cette étude est publié ce jour dans The New England Journal of Medicine. Ces travaux remarquables ont reçu le soutien de l’AFM grâce aux dons du Téléthon.
Alain Fischer, Unité Inserm 768, « Développement normal et pathologique du système immunitaire », Département de Biothérapies et Unité d’Immunologie et d’Hématologie pédiatrique, Hôpital Necker Enfants Malades AP-HP, Université Paris Descartes, Paris © AP-HP, Julian Renard
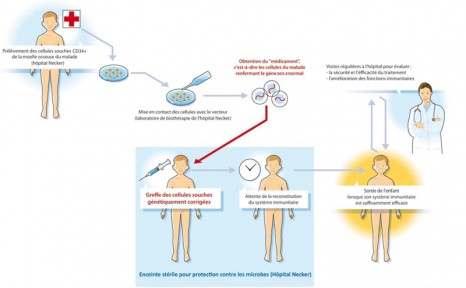
Le déficit immunitaire combiné sévère lié au chromosome X est une maladie génétique rare caractérisée par une absence totale de cellules responsables de la défense de l’organisme contre les infections. Afin de combler ce manque de défenses immunitaires, les enfants touchés par cette maladie sont placés dès la naissance dans des chambres stériles. Pour ces « bébés-bulle », l’espoir de bénéficier un jour de la reconstitution de leur système immunitaire passe par une greffe de moelle osseuse issue d’un donneur familial compatible (idéalement un frère ou une soeur). Toutefois, la réussite de ces greffes est conditionnée par un certain nombre de facteurs limitants (manque de donneurs, risque de mortalité, reconstitution incomplète des défenses immunitaires, etc.).
11 ans déjà !
En 1999, Alain Fischer, Marina Cavazzana-Calvo et Salima Hacein-Bey-Abina (Unité Inserm 768, « Développement normal et pathologique du système immunitaire », Département de Biothérapies et Unité d’Immunologie et d’Hématologie pédiatrique, Hôpital Necker Enfants Malades AP-HP, Université Paris Descartes, Paris) proposent une nouvelle méthode de thérapie génique qui permet de s’affranchir des inconvénients liés à la greffe de moelle osseuse. Elle consiste à insérer une copie normale du gène altéré dans l’organisme des enfants malades.
Pour cela, le gène médicament est inséré en dehors de l’organisme (ex vivo) dans les cellules du patient grâce à un vecteur viral de type rétrovirus. Ce vecteur permet la pénétration du gène dans la cellule, son insertion au sein du génome et la production de la protéine défectueuse chez les enfants. Une fois cette étape réalisée, les cellules corrigées à l’origine des éléments responsables des défenses immunitaires (les lymphocytes T) sont réinjectés au patient.
Les différentes étapes de la thérapie génique du DICS-X
Les premiers enfants ainsi traités par thérapie génique ont pu retrouver un système immunitaire fonctionnel et échapper aux infections à répétition. Quatre d’entre eux ont néanmoins développé une leucémie à la suite de la thérapie. Cette complication était due à l’insertion dans des sites inappropriés (1) du rétrovirus utilisé pour transporter le gène correcteur.
Une efficacité démontrée
Malgré ces problèmes de toxicité liés au rétrovirus, sept enfants pris en charge en France ont continué à produire suffisamment de lymphocytes T et, ce, de façon durable. « A ce jour les taux de lymphocytes T chez ces enfants sont vraiment très bons » nous explique Salima Hacein-Bey-Abina, professeur à l’Université Paris Descartes, « La capacité des précurseurs des lymphocytes T à se diviser a persisté même chez les enfants qui ont dû subir une chimiothérapie. Bien entendu, notre défi est maintenant de pouvoir proposer cette méthode mise au point en 1999 avec des vecteurs plus sûrs, mais son efficacité est aujourd’hui démontrée ».
Deux nouveaux essais en 2010
Deux déficits immunitaires héréditaires feront l’objet d’essais cliniques de thérapie génique en 2010. 5 enfants atteints de DICS-X intégreront un nouvel essai promu par l’AP-HP tandis que 10 enfants atteints du syndrome de Wiskott Aldrich (2) prendront part, en France et en Angleterre, à un essai promu par Généthon (le centre de recherche et de développement des thérapies géniques de l’AFM). Ce dernier essai a débuté en février dernier. Par ailleurs, l’équipe de chercheurs de l’Inserm est toujours impliquée dans l’essai clinique de thérapie génique contre l’adénoleucodystrophie (3).
Notes
(1) Thérapie Génique du déficit immunitaire DICS-X : résultats des premières investigations sur la complication survenue chez deux enfants traités
(2) Le syndrome de Wiskott-Aldrich (WAS) est un déficit immunitaire génétique lié à l’X. Cette pathologie rare, causée par des mutations dans le gène WAS, se caractérise par des hémorragies, des infections récurrentes et de l’eczéma. Les patients souffrent parfois de manifestations auto-immunes ou de lymphomes. Les patients sont traités par greffe de moelle si un donneur compatible est disponible.
(3) Succès dans le traitement de l’adrénoleucodystrophie par greffe de cellules souches porteuses d’un nouveau vecteur de thérapie génique