Un pas de plus vient d’être franchi dans le domaine de la biologie synthétique. Des équipes de chercheurs de l’Inserm et du CNRS de Montpellier, associées au CHRU de Montpellier et à l’université de Stanford ont transformé des bactéries en “espions détecteurs » capables de signaler une pathologie sur la simple présence dans l’urine ou le sang de molécules caractéristiques. Pour réaliser cette prouesse, les chercheurs ont introduit l’équivalent d’un programme informatique dans l’ADN des cellules. Les bactéries ainsi programmées détectent notamment la présence anormale de glucose dans les urines de patients diabétiques. Ces travaux publiés dans la revue Science Translational Medicine marquent les premiers pas de l’utilisation de cellules programmables pour le diagnostic médical.
Les bactéries ont mauvaise réputation et sont souvent considérées comme nos ennemis causant de nombreuses maladies comme la tuberculose ou le choléra. Cependant, elles peuvent aussi être des alliées comme en témoignent les travaux de plus en plus nombreux sur notre flore bactérienne, ou microbiote, qui joue un rôle majeur dans le fonctionnement de l’organisme. Depuis l’avènement des biotechnologies, les chercheurs ont modifié des bactéries pour produire des molécules thérapeutiques ou des antibiotiques. Dans ce nouveau travail, elles deviennent un véritable outil de diagnostic.
Le diagnostic in vitro est basé sur la présence dans les liquides physiologiques (sang, urine par exemple) de molécules caractéristiques d’une pathologie donnée. Du fait de sa non-invasivité et facilité d’usage, le diagnostic in vitro est un enjeu majeur pour la détection précoce des maladies ainsi que pour leur suivi. Cependant, les tests in vitro sont parfois complexes et nécessitent des technologies sophistiquées souvent uniquement disponibles dans les centres hospitaliers.
C’est à ce stade que les systèmes biologiques entrent en jeu. Les cellules vivantes sont de véritables nano-machines capables de détecter et traiter de nombreux signaux et d’y répondre. Elles représentent donc des candidats évidents pour le développement de nouveaux tests diagnostiques puissants. Encore faut-il leur fournir le « programme » adéquat pour réussir à leur faire accomplir les tâches souhaitées.
Pour cela, l’équipe de Jérôme Bonnet au Centre de Biochimie Structurale de Montpellier (Inserm/CNRS/Université de Montpellier) a eu l’idée d’utiliser des concepts de biologie synthétique[1] dérivés de l’électronique pour construire des systèmes génétiques permettant de “programmer” les cellules vivantes à la manière d’un ordinateur.
Le transcriptor : pièce maitresse de la programmation génétiqueLe transistor est l’élément central des systèmes électroniques modernes. Il joue à la fois le rôle d’interrupteur et d’amplificateur de signal. En informatique, en combinant plusieurs transistors, il est possible de construire des « portes logiques », c’est à dire des systèmes répondant à différentes combinaisons de signaux selon une logique prédéterminée. Par exemple une porte logique “ET” à deux entrées produira un signal uniquement si deux signaux entrant sont présents. Tous les calculs effectués par les appareils électroniques que nous utilisons quotidiennement, comme les smartphones, reposent sur l’utilisation de transistors et des « portes logiques ».
Lors de son séjour postdoctoral à l’université de Stanford aux Etats-Unis, Jérôme Bonnet a inventé un transistor génétique, le transcriptor.
L’insertion d’un ou plusieurs transcriptors dans les bactéries les transforme en calculateurs microscopiques. Les signaux électriques utilisés en électronique sont remplacés par des signaux moléculaires contrôlant l’expression génétique. Ainsi, il est à présent possible d’implanter dans les cellules vivantes des “programmes” génétiques simples en réponse à différentes combinaisons de molécules[2].
Dans ce nouveau travail, les équipes de Jérôme Bonnet (CBS, Inserm U1054, CNRS, Université de Montpellier), de Franck Molina (SysDiag, CNRS) associées au professeur Eric Renard (CHRU de Montpellier) et de Drew Endy (Université de Stanford) ont appliqué cette nouvelle technologie à la détection de signaux pathologiques dans des échantillons cliniques.
Les échantillons cliniques sont des milieux complexes dans lesquels la détection de signaux est difficile. Les auteurs ont utilisé les capacités d’amplification du transcriptor pour détecter des marqueurs pathologiques présents même en très petite quantité. Ils ont aussi réussi à stocker plusieurs mois le résultat du test dans l’ADN des bactéries.
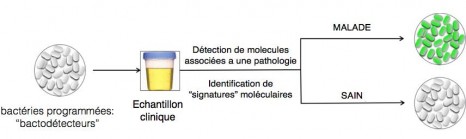
Figure 1: Principe de l’utilisation de bactéries modifiées pour le diagnostic médical. ©J. Bonnet/ Inserm.
Les cellules deviennent ainsi capables de réaliser différentes opérations en fonction de la présence de plusieurs marqueurs, ouvrant la voie à des tests diagnostiques plus précis reposant sur la détection de “signatures” moléculaires.“Nous avons standardisé notre méthode puis confirmé la robustesse de nos systèmes bactériens synthétiques dans les échantillons cliniques. Nous avons aussi mis au point une technique rapide pour connecter le transcriptor à de nouveaux systèmes de détection. Tout ceci devrait faciliter la réutilisation de notre système” précise Alexis Courbet, étudiant en thèse et premier auteur de l’article.
Les auteurs ont connecté au transistor génétique un système bactérien répondant au glucose et détecté la présence anormale de glucose dans les urines de patients diabétiques.
“Nous avons déposé les éléments génétiques utilisés dans ce travail dans le domaine public pour permettre leur libre réutilisation par d’autres chercheurs publics ou privés[3]” précise Jérôme Bonnet.
“Nos travaux se concentrent à présent sur l’ingénierie de systèmes génétiques artificiels pouvant être modifiés à la demande pour détecter différentes molécules marqueurs de maladie” ajoute-t-il. Dans le futur, ces travaux pourraient aussi être appliqués à l’ingénierie de la flore microbienne pour le traitement de diverses pathologies, notamment les maladies intestinales.
Ces travaux ont bénéficié du soutien financier de l’Inserm, du CNRS, du Centre Stanford-France pour la recherche interdisciplinaire, de l’université de Stanford. Jérôme Bonnet est lauréat du programme Atip-Avenir, et est soutenu par la fondation Bettencourt-Schueller.
[2] Bonnet et al. Science, 2013
[3] Qui vise à l’ingénierie rationnelle de systèmes et fonctions biologiques artificiels