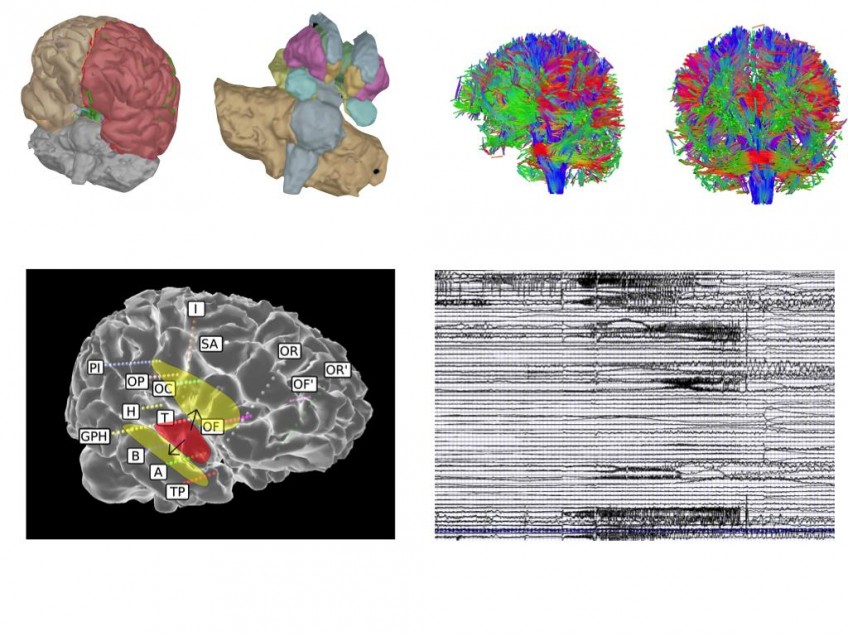
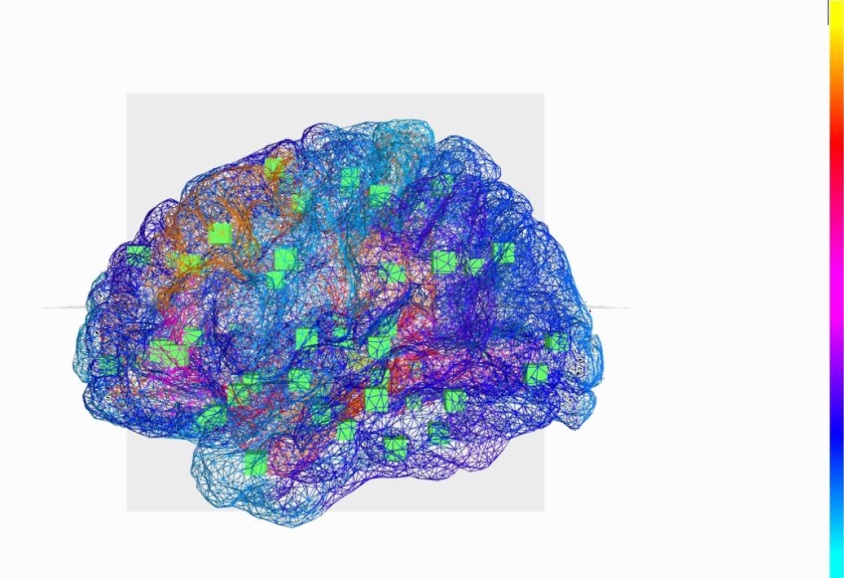
 Le Cerveau Virtuel : reconstruction des régions du cerveau et des connexions qui les relient. Les cubes verts indiquent le centre des régions du cerveau qui sont connectées
Le Cerveau Virtuel : reconstruction des régions du cerveau et des connexions qui les relient. Les cubes verts indiquent le centre des régions du cerveau qui sont connectées
© INS UMR1106 Inserm/AMU.
Des chercheurs du CNRS, de l’Inserm, d’Aix-Marseille Université et de l’AP-HM viennent de créer pour la première fois un cerveau virtuel permettant de reconstituer le cerveau d’une personne atteinte d’épilepsie. Ce travail permet de mieux comprendre le fonctionnement de la maladie mais aussi d’aider à préparer des gestes chirurgicaux par exemple. Ces résultats viennent d’être publiés en ligne sur le site de la revue Neuroimage.
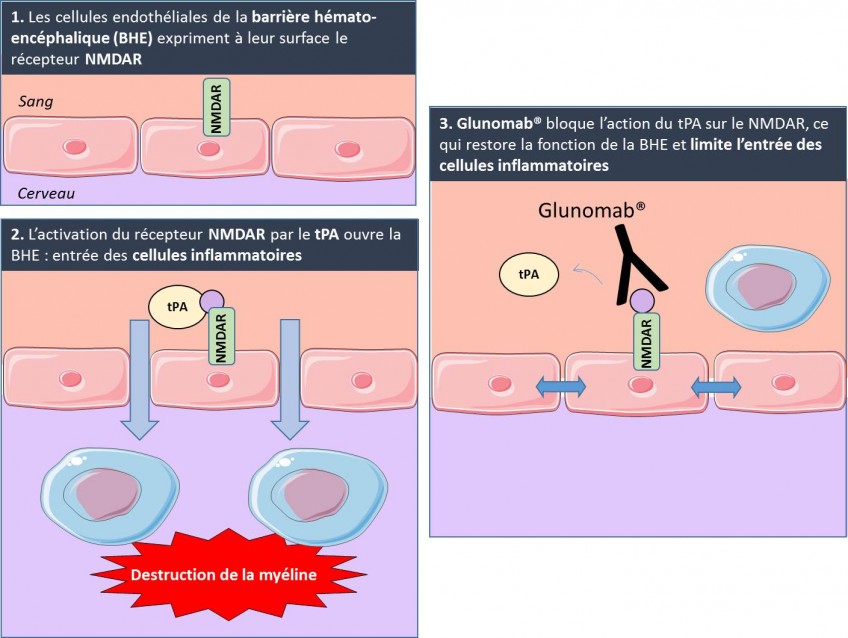
Un pour cent de la population mondiale souffre d’épilepsie. La maladie affecte les individus différemment, d’où l’importance d’un diagnostic et d’un traitement individualisé. Or actuellement les moyens de comprendre les mécanismes de cette pathologie sont peu nombreux et relèvent surtout de l’interprétation visuelle d’un IRM et d’un électroencephalogramme. Cela s’avère d’autant plus difficile que 50% des patients ne présentent pas d’anomalie visible à l’IRM et que la cause de leur épilepsie reste donc inconnue.
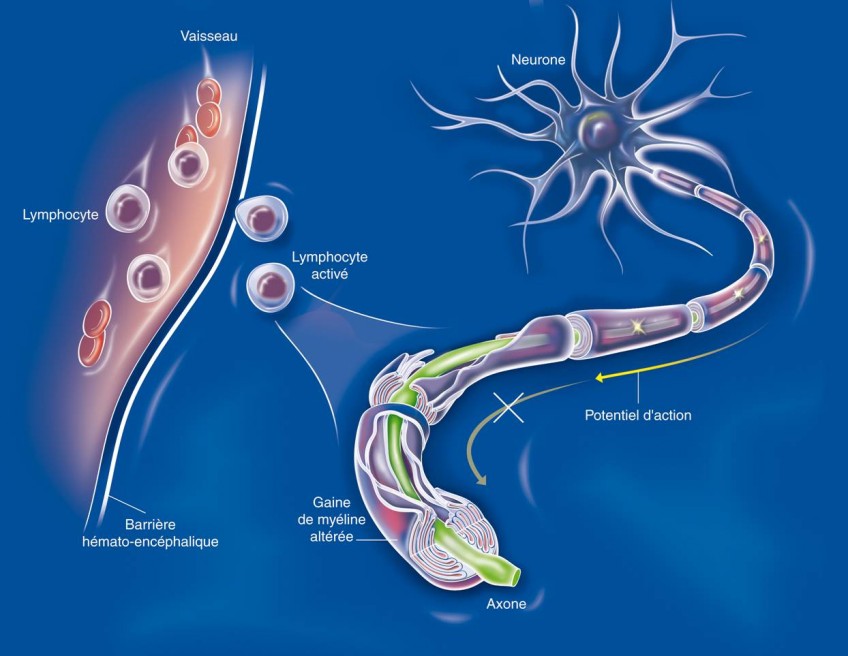
Des chercheurs ont réussi pour la première fois à élaborer un cerveau virtuel personnalisé, en concevant un « modèle » de base et en y additionnant les informations individuelles du patient, comme la façon, propre à chaque individu, dont sont organisées les régions de son cerveau et l’interconnexion des aires entre elles. Le résultat permet de tester sur celui-ci des modèles mathématiques engendrant une activité cérébrale. Les scientifiques ont ainsi pu reproduire le lieu d’initiation des crises d’épilepsie et leur mode de propagation. Ce cerveau a donc une véritable valeur de prédiction du fonctionnement des crises pour chaque patient, ce qui offre un diagnostic beaucoup plus précis.
Par ailleurs, 30% des patients épileptiques ne répondent pas aux médicaments. Leur seul espoir reste alors la chirurgie. Celle-ci est efficace si le chirurgien a de bonnes indications sur les zones à opérer.
Le cerveau virtuel permet aux chirurgiens d’avoir une « plate-forme » virtuelle. Ils peuvent ainsi repérer les zones à opérer, en évitant pour ce faire d’avoir à procéder à un geste invasif, et surtout de préparer l’opération en testant différents gestes possibles, en voyant lequel est le plus efficace et quelles sont ses conséquences, chose évidemment impossible à faire sur le patient.
A terme, le but de l’équipe est d’offrir une médecine personnalisée du cerveau, en proposant, grâce à la virtualisation, des solutions thérapeutiques individualisées et spécifiques pour chaque patient. Les chercheurs travaillent actuellement sur des essais cliniques, afin de démontrer la valeur prédictive de leur découverte. Cette technologie est par ailleurs à l’essai sur d’autres pathologies affectant le cerveau, comme l’AVC, Alzheimer, les maladies neuro dégénératives, ou la sclérose en plaques.
Ces travaux impliquent des chercheurs de l’Institut de neurosciences des systèmes (Inserm/AMU), du Centre de résonance magnétique biologique et médicale (CNRS/AMU/AP-HM), du département épileptologie et du département neurophysiologie clinique de l’AP-HM, et l’Epilepsy Center de Cleveland. Ils ont été réalisés au sein de la Fédération hospitalo-universitaire Epinext (www.epinext.org).
Le Patient Epileptique Virtuel : les régions du cerveau et leurs connexions sont reconstruites par ordinateur. Les simulations numériques génèrent un signal électrique similaire à celui généré par le cerveau pendant les crises. Ces simulations permettent de tester informatiquement de nouvelles stratégies thérapeutiques © INS UMR1106 Inserm/AMU.