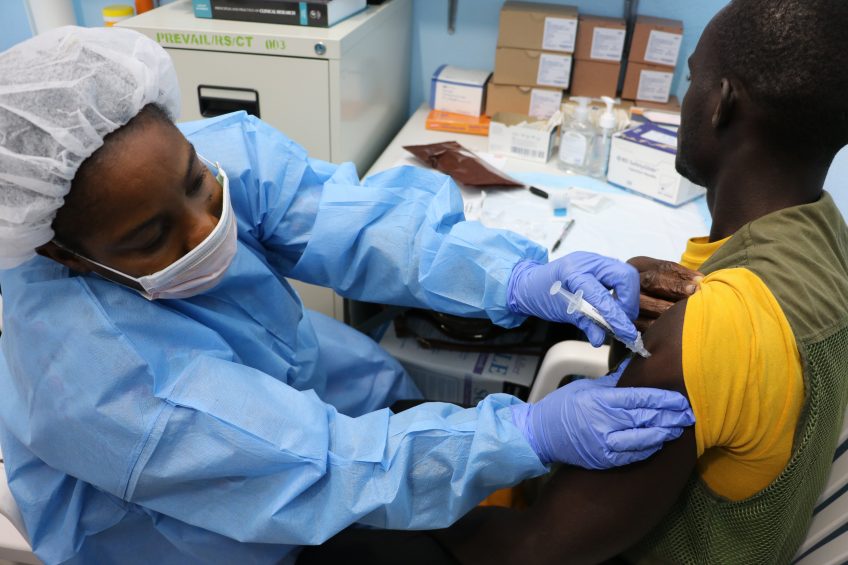
April 3, 2017: Study volunteer receives inoculation at Redemption Hospital in Monrovia on the opening day in Liberia of PREVAC, a Phase 2 Ebola vaccine trial in West Africa. Credit: NIAID
L’Institut national de la santé et de la recherche médicale (Inserm) en France, les Instituts nationaux pour la santé (National Institutes of Health, NIH) aux États-Unis et la Faculté d’hygiène et de médecine tropicale de Londres (London School of Hygiene & Tropical Medicine, LSHTM), en collaboration avec les autorités sanitaires de Guinée et du Libéria, lancent un nouvel essai clinique de grande taille portant sur des candidats vaccins contre Ebola, sous l’égide du consortium international PREVAC (Partnership for Research on Ebola VACcination, Partenariat pour la recherche sur la vaccination contre Ebola). Cet essai vise à identifier les stratégies de vaccination les plus prometteuses pour protéger les personnes de la fièvre Ebola, afin de prévenir ou de maîtriser rapidement une future épidémie. Plus de 5 000 adultes et enfants vivant dans les pays d’Afrique de l’Ouest, proches de l’épicentre de l’épidémie de fièvre Ebola de 2014-2016, seront recrutés. Un centre supplémentaire est également prévu en Sierra Leone. L’essai PREVAC résulte d’un partenariat de recherche qui implique l’Inserm, les NIH, la LSHTM et le consortium de recherche clinique Ouest Africain (West african clinical research consortium)
[1]. Les compagnies pharmaceutiques Janssen Vaccines & Prevention, B.V, une des entreprises Janssen Pharmaceutical de Johnson & Johnson, Bavarian Nordic et Merck Sharp & Dohme, Corp (MSD en dehors des Etats-Unis et du Canada) fournissent les vaccins testés dans l’essai PREVAC. L’essai comparera trois stratégies de vaccination contre Ebola à un placebo. Il sera réalisé en deux étapes, la première se déroulant en Guinée et au Libéria. En Guinée, l’Inserm est promoteur de l’essai, qui est le soutien des NIH et en collaboration avec les autorités guinéennes. Il implique un partenariat avec l’organisation non gouvernementale
ALIMA (The Alliance for International Medical Action). Les NIH sont promoteurs de l’essai qui se déroule au Libéria, au titre de leur collaboration avec le Ministère de la Santé du Libéria et avec le Partenariat pour la recherche sur le virus Ebola au Liberia (Partnership for Research on Ebola Virus In Liberia, PREVAIL). Sous réserve de confirmation du financement, la LSHTM sera promoteur de l’essai en Sierra Leone, conduit par l’University of Sierra Leone’s College of Medicine and Allied Health Sciences. Au cours de la première étape, l’essai évalue l’une des trois stratégies. Cette première stratégie consiste en une primovaccination suivie d’un rappel, combinant deux vaccins différents (l’un fabriqué par Janssen et l’autre par Bavarian Nordic). Elle sera comparée à un régime placebo. Le recrutement pour cette étape a démarré le 27 mars en Guinée et le 3 avril 2017 au Libéria. Lors de la seconde étape, qui devrait démarrer au second semestre 2017, l’essai évaluera les trois stratégies de vaccination, incluant ainsi deux autres stratégies impliquant le vaccin de Merck Sharp & Dohme, Corp. Le 29 mars 2016, le directeur général de l’Organisation mondiale de la santé (OMS) a annoncé la fin de l’urgence de santé publique de portée internationale relative à la flambée Ebola
[2]. À la fin de cette épidémie, même si d’importants progrès ont été réalisés, plusieurs questions relatives à la durabilité de la réaction immunitaire des candidats vaccins en développement restent sans réponse. L’essai PREVAC évaluera la rapidité, l’intensité et la durée des réactions immunitaires générées par les différentes stratégies de vaccination, ainsi que l’innocuité et la tolérance des différents vaccins, en particulier chez les enfants.
Pour Yves Levy, PDG de l’Inserm, Anthony S. Fauci, directeur du NIAID (National Institute of Allergy and Infectious Diseases) des NIH et Peter Piot, directeur de la LSHTM, « nos établissements, l’Inserm, les NIH et la LSHTM, ont conçu et lancé ce partenariat de recherche international unique, avec nos collègues des pays d’Afrique de l’Ouest les plus touchés par la fièvre Ebola pour répondre aux questions qui subsistent sur l’innocuité et l’immunogénicité des stratégies des candidats vaccins contre Ebola. Cela nous permettra de mieux lutter contre les épidémies futures de fièvre Ebola. »
La première étape de l’étude PREVAC évaluera une stratégie primovaccination-rappel (stratégie « prime-boost ») avec les vaccins expérimentaux de Janssen et de Bavarian Nordic : – Administration d’une première dose d’Ad26.ZEBOV, suivie 8 semaines plus tard d’une dose de rappel de MVA-BN-Filo
[3]. Cette stratégie de vaccination sera comparée à un régime identique en termes de posologie et de durée, mais constitué de deux placebos.
La deuxième étape de l’étude PREVAC évaluera les trois stratégies : celle utilisée dans la première étape et deux autres régimes impliquant le vaccin expérimental de Merck Sharp & Dohme, Corp: – Administration d’une première dose de rVSV∆G-ZEBOV-GP
[4], suivie 8 semaines plus tard d’une dose de rappel de rVSV – Administration d’une première dose de rVSV ∆G-ZEBOV-GP, suivie 8 semaines plus tard d’un placebo inerte Chacune de ces stratégies de vaccination sera comparée à un régime identique en termes de posologie et de durée, mais constitué de deux placebos.
PREVAC en bref Il n’existe à l’heure actuelle aucun vaccin homologué pour prévenir la fièvre Ebola, même si certains vaccins sont parvenus aux derniers stades de développement. Pour mieux se préparer aux épidémies Ebola et pour contribuer à les contenir à l’avenir, il est essentiel de poursuivre les recherches sur la stratégie de vaccination afin de prévenir la fièvre Ebola. PREVAC (Partnership for Research on Ebola VACcination, Partenariat pour la recherche sur la vaccination contre le virus Ebola) est un consortium de recherche qui regroupe les autorités sanitaires de trois pays d’Afrique de l’Ouest, la Guinée, le Libéria et la Sierra Leone, et leurs partenaires internationaux, l’Institut national de la santé et de la recherche médicale (Inserm) en France, l’Institut national de l’allergie et des maladies infectieuses (National Institute of Allergy and Infectious Diseases, NIAD) des Instituts nationaux pour la santé (National Institutes of Health, NIH) (NIAID/NIH) aux États-Unis et la Faculté d’hygiène et de médecine tropicale de Londres (London School of Hygiene & Tropical Medicine, LSHTM) au Royaume-Uni. L’ONG ALIMA (The Alliance for international medical Action) est partenaire de ce consortium. Les sociétés pharmaceutiques Janssen Vaccines & Prevention, une des entreprises de Janssen Pharmaceutical de Johnson & Johnson, Bavarian Nordic et Merck Sharp & Dohme, Corp (MSD hors des États-Unis et du Canada) fournissent les vaccins expérimentaux testés dans l’essai PREVAC. L’essai PREVAC est une étude clinique de phase 2 réalisée en Afrique de l’Ouest. Il s’agit d’un essai randomisé qui vise à comparer trois stratégies expérimentales de vaccination contre Ebola à la prise de placebos, pour déterminer si ces stratégies sont sûres et capables de déclencher une réaction immunitaire durable capable de protéger contre la fièvre Ebola. Pendant la première étape, l’essai prévoit de recruter un maximum de 600 participants âgés de 12 ans et plus. Durant la seconde étape, 4 900 participants devraient être inclus : 3 500 adultes en bonne santé âgés de 18 ans ou plus et 1 400 enfants âgés de 1 à 17 ans. L’étude sera menée au départ dans deux centres en Guinée (Conakry/Landréah et Maférinyah) et dans un centre au Libéria (Monrovia), avec un centre supplémentaire en Sierra Leone en attente de confirmation. Les principaux objectifs de l’essai PREVAC sur le vaccin contre Ebola sont les suivants :
- Continuer à étudier l’innocuité de trois stratégies de vaccination contre Ebola et leur capacité à déclencher une réaction immunitaire durable protégeant contre le virus Ebola
- Évaluer ces stratégies de vaccination dans la population générale et dans des groupes importants, tels que les enfants, pour lesquels on ne dispose que de données limitées
- Obtenir des informations sur la durée de la réponse immunitaire induite par le vaccin.
En Guinée, deux centres de vaccination ont été mis en place, l’un à Conakry (dans une zone urbaine) et l’autre à Maferinyah (dans une zone rurale). Le Libéria disposera d’un centre de vaccination à Monrovia. Selon Yazdan Yazdanpanah, investigateur principal de l’essai PREVAC, « la difficulté réside dans l’identification d’au moins un vaccin sûr, efficace et durable afin de prévenir ou de maîtriser la prochaine épidémie de fièvre Ebola chez les adultes et chez les enfants. »
« Les équipes médicales d’ALIMA ont été en première ligne pour soigner les patients atteints de la fièvre Ebola en Guinée. Aujourd’hui, nous savons que ce virus peut réapparaître à tout moment. Par conséquent, nous souhaitons continuer à aider la population en poursuivant la recherche d’un vaccin capable de la protéger des futures épidémies » a indiqué Solenne Barbe, responsable du programme pour ALIMA.
Après la période de recrutement, les participants seront suivis fréquemment lors de visites régulières pendant au moins 12 mois. Des équipes de médecins, chercheurs et anthropologues collaboreront sur le terrain pour s’assurer que l’essai se déroule sans incident et pour répondre aux questions des participants à l’étude et des volontaires potentiels. Le personnel de l’étude surveillera l’état de santé des participants, consignera les éventuels évènements indésirables et recueillera des échantillons de sang lors des visites de suivi après les vaccinations. Un comité indépendant de surveillance des données et de l’innocuité (CISDI) surveillera étroitement les données d’innocuité et de réaction immunitaire pendant toute la durée de l’essai. Les enfants âgés de moins de 12 ans ne seront pas recrutés au départ. Le CISDI commencera par examiner les données des enfants âgés de 12 à 17 ans afin de déterminer si l’essai peut être étendu en toute sécurité aux enfants âgés de 5 à 11 ans. Après un autre examen des données d’innocuité, le CISDI examinera si la vaccination des enfants âgés d’un à 4 ans peut démarrer. Les participants à cet essai ne courent aucun risque d’infection par le virus Ebola avec les vaccins de l’étude. Les vaccins à l’étude ne contiennent pas de virus Ebola vivant. Ils contiennent un seul gène codant pour une seule protéine du virus Ebola. Cette protéine ne peut pas entraîner une infection. Le principe est le même que pour de nombreux autres vaccins existants. Le site ClinicalTrials.gov contient d’autres informations sur l’essai sous l’identifiant
NCT02876328.
Comment fonctionne un vaccin préventif ? La vaccination préventive implique généralement l’administration d’une forme atténuée ou inactivée d’un agent infectieux (ou d’un ou plusieurs de ses composants) à une personne en bonne santé. L’objectif est de déclencher une réaction immunitaire qui implique le développement de cellules « mémoire » du système immunitaire capables de reconnaître immédiatement le pathogène s’il infecte la personne par la suite.
[1] Etabli en 2015 par des scientifiques du Liberia, de Guinée, et de Sierra Leone, et désormais du Mali, le consortium conduit des recherches collaboratives pour prévenir et aider à la réponse aux futures flambées d’Ebola et d’autres maladies infectieuses, et donc à la préparation anticipée du dispositif de santé de cette sous-région de l’Afrique de l’Ouest.
[2] http://www.who.int/mediacentre/news/statements/2016/ihr-emergency-committee-ebola/fr/ [3] Le vaccin Ad26.ZEBOV est développé par Janssen Vaccines & Prevention B.V., une des entreprises Janssen Pharmaceutical de Johnson & Johnson et le vaccin MVA-BN-Filo a été développé par Bavarian Nordic S/A. Ce régime expérimental de vaccin contre Ebola a été développé dans un programme de recherche collaborative avec les NIH. Les autres financeurs qui ont soutenu le développement de ce régime de vaccin comprennent l’Initiative pour des médicaments innovants (IMI) en Europe et l’autorité pour la recherche et le développement biomédicaux avancés (Biomedical Advanced Research and Development Authority, BARDA), un bureau du Département de la santé et des services humains (Department of Health and Human Services) aux États-Unis.
[4] Le vaccin rVSV ∆G-ZEBOV-GP a été développé par l’Agence de santé publique du Canada. NewLink Genetics a obtenu une licence du vaccin, et le 24 novembre 2014, Merck Sharp & Dohme, Corp. et NewLink Genetics Corp. ont conclu un accord de licence international exclusif dans lequel Merck assume la responsabilité de la recherche, du développement, de la fabrication et de la distribution du vaccin expérimental. Les gouvernements canadien et américain, entre autres, ont contribué par un soutien financier.
« Funding provided in part by NCI contract HHSN261201500003I through the Frederick National Laboratory for Cancer Research. The content of this publication does not necessarily reflect the views or policies of the Department of Health and Human Services, nor does mention of trade names, commercial products, or organizations imply endorsement by the U.S. Government. »
Ces contenus pourraient aussi vous intéresser :