L’équipe dirigée par Daniel Aberdam au sein de l’Unité Inserm 976 «Immunologie, dermatologie, oncologie » a réussi à restaurer in vitro la fonction des cellules de cornée saines à partir de cellules de patients aveugles souffrant de dysplasie ectodermique. Ces résultats publiés dans PNAS représentent la première étape pour tenter de restaurer la vision de ces patients.
Photo: © Serimedis/Inserm
Les dysplasies ectodermiques sont des syndromes rares caractérisés par un développement anormal de la peau et d’autres dérivés de l’ectoderme comme les dents, les ongles ou encore la cornée. Certaines formes de la maladie sont associées aux mutations du gène p63 qui engendrent la perte de la vision chez ces patients.
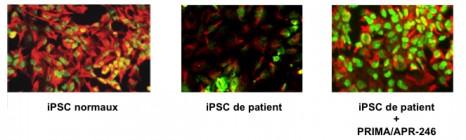
Daniel Aberdam et ses collaborateurs ont dans un premier temps reprogrammé des cellules de patients atteints de cécité en cellules souches pluripotentes induites (iPSC) porteuses du défaut génétique. Dans un second temps, ils ont utilisé un protocole que l’équipe avait mis au point en 2003 pour différencier les cellules souches pluripotentes en cellules de la peau et de la cornée. Cela leur a permis de vérifier que ce modèle cellulaire reproduisait la maladie puisque les cellules pluripotentes mutées ne sont plus capables de produire des cellules de cornée. «Nous avons observé que les iPSC obtenues à partir des cellules des patients atteints de dysplasie ectodermique peuvent se développer en progéniteurs ectodermiques mais ne parviennent pas à se développer plus avant en kératinocytes ni en cellules cornéennes normales » explique Daniel Aberdam. Les cellules malades, même retransformées en cellules capables de redonner tous les types de cellules possibles, conservent donc le défaut initial dans leur code génétique.
Contourner le défaut génétique
La création de ce modèle a ensuite permis aux chercheurs d’ observer finement ce qui se passait dans la cellule iPSC au moment de son engagement dans une voie de différenciation. Ils ont trouvé qu’une petite molécule, appelée PRIMA-1/APR-246, déjà utilisée en thérapie cancéreuse[1] permet de restaurer une différenciation normale.
Grâce à cette molécule, il semble donc possible d’inverser la différenciation cornéenne altérée et restaurer la voie de signalisation associée au gène p63.
« Notre étude suggère l’éventuelle capacité de PRIMA-1/APR-246 à restaurer les déficiences visuelles de certains patients atteints du syndrome de dysplasie ectodermique, capacité qui doit être testée bientôt » conclut Daniel Aberdam. Dans la mesure où la molécule PRIMA-1 est bien tolérée dans les essais cliniques en injection systémique, l’équipe envisage, avec le service ophtalmologiste de l’hôpital St-Louis, de planifier des essais cliniques sur des patients atteints de dysplasie ectodermale liée à p63.
Ce modèle cellulaire pourrait également servir de base pour le criblage de molécules- médicaments susceptibles de cibler d’autres mutants p63.
Photo : ©D.Aberdam/Inserm
Illustration de l’effet de Prima sur la production de cellules de cornée à partir d’iPSC de patients après 10 jours de différenciation. Les deux marqueurs spécifiques de la cornée: la cytokératine K12 (en rouge) et le facteur de transcription pax-6 (en vert) sont bien présents dans l’image la plus à droite, signe que la production de cellules de cornée est bien restaurée.
[1] Récemment testée dans un essai clinique de phase II pour des patients présentant un cancer de la prostate