L’équipe de Xavier Nissan à l’Institut des cellules souches pour le traitement et l’étude des maladies monogéniques (ISTEM- UEVE U861/Inserm/ AFM) dirigé par le Dr Marc Peschanski, est parvenue à identifier un mécanisme moléculaire qui, dans la progéria, protège les cellules neurales d’un vieillissement accéléré. Ce travail, mené en collaboration avec l’équipe de Nicolas Lévy (Unité Inserm/UMRS910, Faculté de Médecine La Timone – Université de la Méditerranée), a été réalisé grâce aux cellules souches iPS (1). Il permet de comprendre pourquoi les fonctions cognitives des patients atteints de cette maladie sont préservées. L’article est publié en ligne le 21 juin 2012 dans la revue Cell Reports et a été financé notamment par l’AFM-Téléthon.
Le syndrome de Hutchinson-Gilford, connu sous le nom de progéria, est une maladie génétique très rare (une centaine de cas dans le monde) qui induit un vieillissement prématuré et accéléré des patients. La mutation à l’origine de ce syndrome affecte le gène LMNA qui code pour les protéines dites « lamines » A et C. Les lamines interviennent dans le maintien de la structure de la membrane des noyaux cellulaires. Elles donnent au noyau sa forme, la rend rigide et permet les communications à l’intérieur des cellules. Dans le cas de la progéria, c’est la lamine A qui est défaillante. Sous sa forme mutée, elle devient toxique et détériore les membranes du noyau, perturbe le message et cause le vieillissement accéléré des cellules (Figure 1). C’est en 2003 que l’origine de cette maladie a été mise en évidence par l’équipe du Dr Nicolas Lévy, à partir de travaux déjà financés à l’époque par le Téléthon.
L’évolution de ce syndrome est fulgurante : on estime que, chaque année, les enfants atteints vieillissent de plus de dix ans, conduisant à leur décès prématuré entre 13 et 16 ans. Ce vieillissement accéléré touche la plupart des tissus : la peau, les vaisseaux sanguins, le cœur, les os ou encore les muscles. Très rapidement, les patients souffrent de troubles musculaires et squelettiques, d’un retard de croissance (la taille des malades ne dépassant pas 110 cm pour un poids de 15 kg). En revanche, les enfants atteints ne perdent aucune de leurs capacités cognitives, ce qui a depuis toujours été considéré comme un phénomène surprenant, au vu de l’atteinte générale dont ils sont victimes par ailleurs.
Une stratégie efficace
Les équipes d’I-Stem multiplient les succès dans la maitrise du potentiel thérapeutique des cellules souches (embryonnaires ou iPS) comme dans l’identification des mécanismes moléculaires impliqués dans des pathologies rares (2). Cette fois, les chercheurs se sont penchés sur les mécanismes moléculaires impliqués dans la progéria. Partant du constat que dans ce syndrome, seules les cellules neurales étaient préservées du vieillissement accéléré, les chercheurs ont formulé l’hypothèse selon laquelle un mécanisme moléculaire physiologique présent de façon spécifique dans le système nerveux pouvait expliquer le phénomène. Ils ont identifié ce mécanisme sous la forme d’un contrôle épigénétique inhibiteur de l’expression du gène LMNA, assuré par un microARN qui est naturellement exprimé massivement et uniquement dans les neurones.
Mir9 préserve les cellules neurales
Pour comprendre les mécanismes moléculaires de la progéria, les équipes d’Evry et de Marseille ont prélevé des échantillons de peau chez des malades et en ont dérivé des cellules souches iPS. Ces cellules iPS ont ensuite été différenciées en plusieurs types cellulaires (cellules de peau, d’os, du muscle et du cerveau), ce qui a permis d’observer que toutes ces cellules exprimaient la protéine responsable de ce syndrome (la lamine A) à l’exception d’une, les cellules nerveuses, qui en étaient dépourvus (Figure 2). La préservation des cellules neurales chez les patients atteints de progeria tenait donc à l’absence d’expression du gène LMNA. L’origine de cette absence d’expression restait toutefois inconnue.
Xavier Nissan, I-Stem
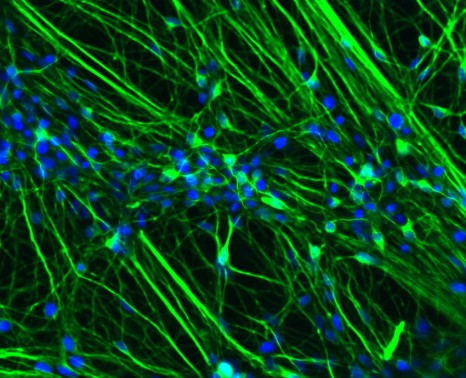
Neurones dérivés de cellules iPS progeria
Neurones dérivés de cellules souches induites à la pluripotence à partir de prélèvements réalisés chez des patients atteints de progeria. L’ADN est marqué en bleu, les neurones en vert (marquage de la protéine Tuj1). Le marquage de la lamine A devrait être en rouge, mais il est totalement absent dans cette population cellulaire.
« Nous avions démontré que les neurones présentaient une particularité qui les protégeait du vieillissement accéléré observé dans la progeria. Il restait ensuite à comprendre les mécanismes qui conduisaient à cette absence d’expression de la lamine A au niveau neural. » explique Xavier Nissan. « Pour répondre à cette question, nous sommes partis à la recherche des facteurs qui pouvaient bloquer spécifiquement l’expression de ce gène au niveau du système nerveux central et c’est là que nous avons identifié miR-9 ». Les chercheurs ont en effet mis en évidence le rôle de ce petit ARN, miR-9, membre d’une vaste famille de modulateurs épigénétiques.
« Plusieurs informations nous ont laissé penser que miR-9 était un suspect idéal. D’abord parce que, des travaux précédents avaient montré qu’il était un des microARNs les plus abondants dans les neurones, et ensuite parce qu’il présente la particularité de n’être présent à cette concentration dans aucune autre cellule de l’organisme ». Ainsi, grâce à des manipulations diverses de son expression – en augmentant ou en abaissant sa concentration dans divers types cellulaires – les chercheurs ont non seulement confirmé qu’il contrôlait bien la production de lamine A au niveau de neurones mais également qu’il pouvait corriger les désordres moléculaires associés à la maladie, en restaurant une morphologie normale des noyaux.
L’objectif du Dr Xavier Nissan et de son équipe est désormais de trouver un moyen pour utiliser ou imiter le microARN 9 à des fins thérapeutiques. Plusieurs travaux dans ce sens ont été lancés cette année dans les laboratoires d’I-Stem.
Notes :
(1) Les cellules souches pluripotentes induites (iPS: Induced Pluripotent Stem cells) sont des cellules adultes reprogrammées génétiquement de façon à leur conférer des propriétés similaires à celles de cellules souches embryonnaires. Elles permettent aux chercheurs de disposer d’une source de cellules reproductibles à l’infini en laboratoire, à partir desquelles on peut à volonté créer des populations cellulaires matures en appliquant des protocoles de différenciation.
(2) Novembre 2009 – Première reconstitution d’un épiderme à partir de cellules souches embryonnaires humaines
Août 2011 – Une peau pigmentée grâce aux cellules souches
Mars 2011 – Identification des mécanismes jusqu’alors inconnus impliqués dans la dystrophie myotonique de Steinert.