Le développement d’une tumeur exerce une pression permanente anormale non négligeable sur les cellules saines avoisinantes. L’équipe CNRS/UPMC/Institut Curie dirigée par Emmanuel Farge, directeur de recherche Inserm à l’Institut Curie, vient de découvrir que cette force pouvait y induire l’expression de gènes tumoraux. La contrainte physique provoquée par la croissance tumorale provoquerait même les premières phases d’une transformation tumorale des tissus avoisinants. Cette découverte majeure est publiée dans Nature du 11 mai 2015.
Lorsqu’une tumeur prolifère, elle induit progressivement une pression anormale et permanente sur les cellules saines avoisinantes. Cette contrainte peut-elle transformer les cellules saines comprimées en cellules tumorales et avoir un effet sur le développement de la tumeur ? C’est l’approche originale qu’étudie l’équipe Mécanique et génétique du développement embryonnaire et tumoral[1] dirigée par Emmanuel Farge, directeur de recherche Inserm.
Dans un premier temps, les chercheurs ont évalué, dans des modèles expérimentaux, la pression exercée par la croissance d’une tumeur du côlon sur les tissus voisins. Au passage, ils démontrent que cette contrainte mécanique active la voie de signalisation béta-caténine dans les tissus sains voisins de la tumeur, et entraîne l’activation de gènes tumoraux. « La béta-caténine est bien connue pour activer le processus tumoral dans de nombreux cancers », note Emmanuel Farge.
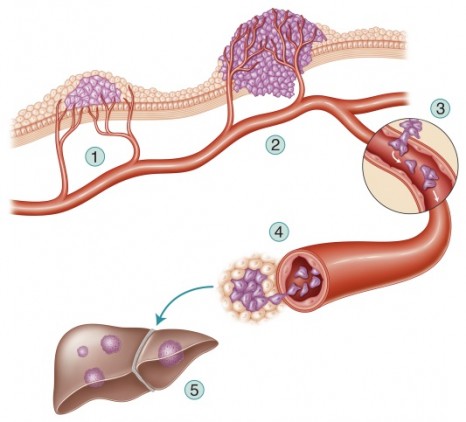
La mécanique du cancer : des ruses pour se propager
Grâce à des aimants, l’équipe a ensuite mimé dans des tissus sains chargés de vésicules magnétiques les forces mécaniques induites par une tumeur sur les tissus alentours et en a observé les conséquences. « Après deux semaines d’une telle contrainte mécanique, on observe une augmentation de la phosphorylation (i.e. l’activation) de la béta-caténine ainsi que sa relocalisation dans le noyau des cellules », observent les scientifiques. Sous l’effet de la pression, la protéine béta-caténine se détache de la membrane cellulaire pour aller dans le noyau où elle active alors des oncogènes qui favorisent la croissance tumorale.
Au bout d’un mois, une surexpression du gène tumoral c-Myc, cible de la béta-caténine, est alors détectée, provoquant la division anarchique des cellules saines, mais aussi celle du gène cible Zeb-1, responsable de la perte d’adhésion cellulaire à l’origine de l’invasivité et de la métastase.
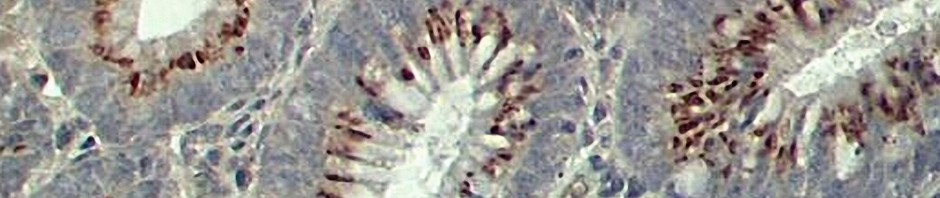
Après 2-3 mois, il se forme des foyers d’anomalies au niveau des cryptes du colon (accroissement de la taille des cryptes et altération de leur structure) qui correspondent aux premières étapes de la transformation tumorale. « L’activation par une contrainte mécanique de la voie de signalisation de la béta-caténine dans les tissus sains entourant la tumeur présage d’un nouveau mode de propagation tumorale, indique Emmanuel Farge. Elle crée une boucle d’autorégulation amplificatrice, une réaction en chaîne, un véritable « effet domino » : les modifications tumorales mécaniquement induites par la tumeur sur les cellules génétiquement saines voisines vont provoquer une croissance anormale de ces cellules, qui elle-même va appliquer des contraintes anormales sur ses cellules non encore tumorales avoisinantes, et ainsi de suite, selon un processus susceptible d’amplifier considérablement la croissance et la propagation tumorale. »
En outre, elle pourrait contribuer à l’hétérogénéité tumorale : les processus tumoraux enclenchés dans les cellules avoisinantes pourraient engendrer des cellules tumorales aux caractéristiques distinctes du cœur de la tumeur et ne répondant pas de la même manière au traitement. Ce mode de prolifération constituerait alors un facteur de résistance aux traitements thérapeutiques.
Tout n’est donc pas purement biochimique dans le développement du cancer du côlon. Les contraintes mécaniques anormales, activatrices de biomolécules tumorales, apparaissent comme un nouveau rouage possible de la progression et de l’invasion tumorale.
Cette découverte révèle que les compressions mécaniques provoquées par la croissance de la tumeur sont susceptibles de modifier ses cellules saines avoisinantes y activant les transformations tumorales amplifiant son développement.
Ces données devraient être intégrées dans les approches thérapeutiques car l’élimination complète des tumeurs devra passer par une action sur l’ensemble des mécanismes mis en œuvre par la tumeur pour croître.