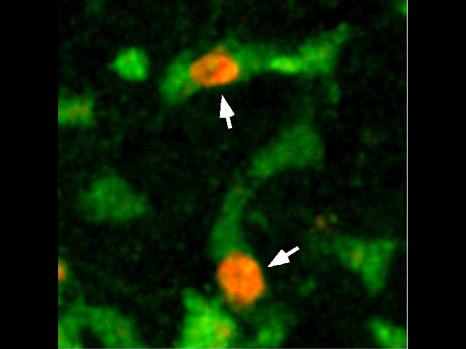
Le cancer osseux primitif se développe suite à la dérégulation des cellules qui fabriquent continuellement nos os. Dans un contexte cancéreux, ces cellules peuvent dégénérer et former de l’os de façon anarchique sans aucune organisation définie. Des chercheurs de l’Unité l’Inserm 957 » Physiopathologie de la Résorption Osseuse et Thérapie des Tumeurs Osseuses Primitives » à Nantes viennent de mettre au point un traitement innovant stoppant le cercle vicieux qui permet au cancer osseux de se développer.
Publiée aujourd’hui dans la revue Nature Communications, leur étude montre une inhibition de la progression tumorale et une diminution de la dégradation osseuse, associées à un allongement de la survie chez l’animal.
Touchant principalement les enfants et les adolescents avec un pic d’incidence vers 15 ans, les cancers primitifs de l’os affichent des taux de survie à 5 ans de 50 à 70 % dans les meilleurs cas pour les formes localisées, mais de 20 à 30% en cas de métastases, de rechute ou de résistance au traitement. Un pronostic qui n’a pas évolué au cours des 30 dernières années. Bien qu’ayant des causes diverses et encore mal connues, ces cancers, qu’ils s’agissent de l’ostéosarcome, du sarcome d’Ewing ou du chondrosarcome, semblent impliquer des dysfonctionnements cellulaires similaires. Cependant, depuis une quinzaine d’années aucune avancée majeure dans la prise en charge thérapeutique de ces cancers n’a vu le jour.
L’os est un tissu vivant !
En condition physiologique, le tissu osseux est en continuel remaniement comportant des phases de destruction osseuse et des phases de formation osseuse. L’os est majoritairement formé par de deux types de cellules : les ostéoclastes et les ostéoblastes qui interagissent constamment pour maintenir un équilibre entre destruction et formation osseuse. Les ostéoblastes sont les cellules responsables de la formation de l’os. Les ostéoclastes sont quant à elles chargées de la résorption osseuse. Toute dérégulation de la balance formation/destruction osseuse est à l’origine de la pathologie cancéreuse.
Grâce aux recherches précédemment menées par l’équipe de chercheurs de l’Inserm, il est clairement établi qu’un déséquilibre entre l’action des ostéoblastes et des ostéoclastes est impliqué dans le développement des tumeurs osseuses primitives. En effet, dès lors qu’une cellule tumorale se développe sur un site osseux, on observe une résorption importante des os causant leur fragilisation (lésions, fractures…).
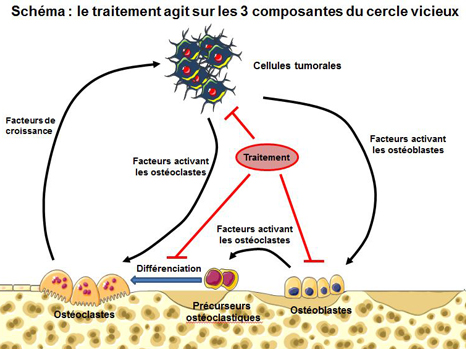
Bloquer le cercle vicieux : un défi réussi
Les tumeurs osseuses primitives « se servent » du micro environnement osseux pour pouvoir proliférer. Les cellules tumorales perturbent l’équilibre naturel du système en libérant des protéines appelées « facteurs de croissance ». Ces molécules ont la capacité d’activer les ostéoclastes/ostéoblastes entrainant non seulement d’importantes dégradations de l’os mais également la libération d’autres facteurs de croissance normalement emprisonnés dans l’os. Libérés, ils vont alors à leur tour, stimuler la croissance de la tumeur. Plus la quantité de facteurs de croissance présente dans le micro-environnement de la tumeur est importante, plus la tumeur prolifère. C’est ce qu’on appelle le « cercle vicieux ».
Aucun traitement à ce jour n’inhibe ces trois composantes du cercle vicieux à savoir la tumeur, les ostéoblastes et les ostéoclastes.
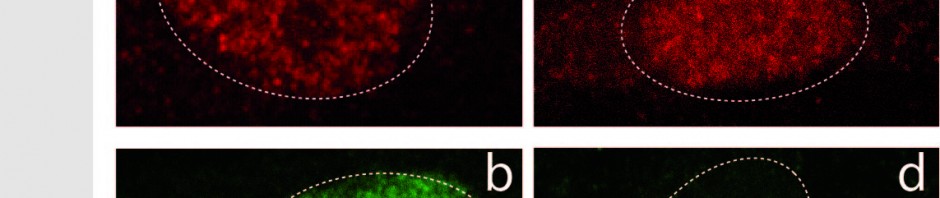
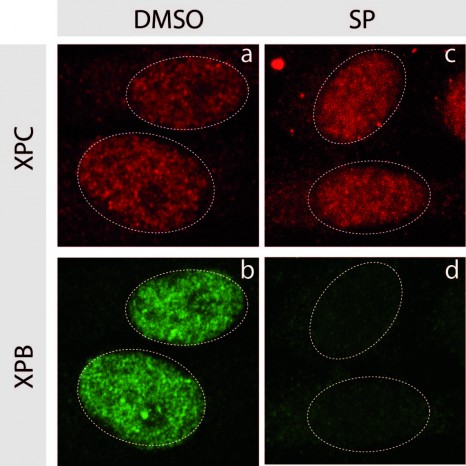
L’idée des chercheurs a été de s’intéresser au fait qu’une cellule peut devenir tumorale en cas de dérégulation de l’expression de certains gènes dits « facilitateurs de tumeurs ». Un certain nombre de protéines participent à cette régulation d’expression, notamment les protéines de la famille BRD. Les chercheurs montrent pour la première fois qu’un traitement innovant ciblant ces protéines BRD régulatrices de la transcription, inhibe les trois composantes du cercle vicieux à savoir les cellules tumorales et la différenciation des ostéoclastes et des ostéoblastes.
En inhibant chimiquement la protéine BRD4 (appartenant à la famille BRD), les chercheurs ont réussi à diminuer la prolifération de tumeurs osseuses primitives tout en maintenant l’architecture osseuse.
Des expériences complémentaires ont été réalisées sur des biopsies de patients dans le but d’illustrer et de confirmer ces résultats obtenus chez l’animal.
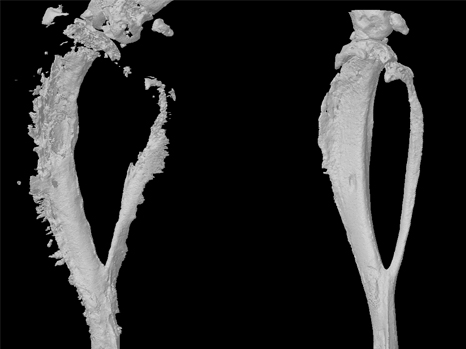
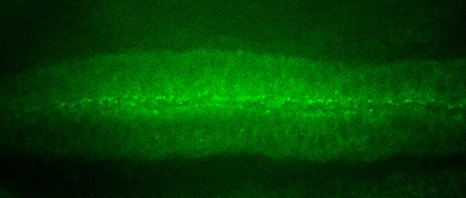
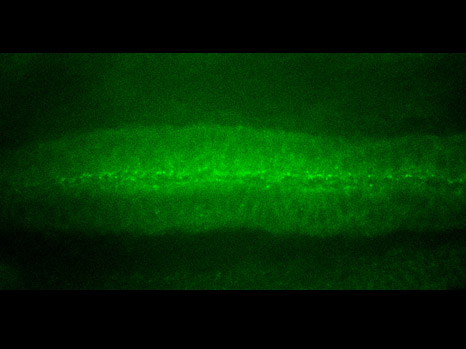
Reconstruction en 3D d’un tibia de souris atteinte d’une tumeur osseuse primitive (à gauche) et après traitement (à droite) ©Inserm/F Lamoureux
« Notre étude montre clairement une inhibition de la progression tumorale et de la dégradation osseuse, associées à un allongement de la survie chez l’animal » précise François Lamoureux, à l’Inserm. Alors qu’à 32 jours toutes les souris contrôles étaient décédées, celles qui ont pu bénéficier du traitement étaient encore en vie après 40 jours. «Ces travaux nous permettent d’envisager sérieusement le développement d’un nouveau traitement pour les patients atteints de tumeurs osseuses primitives touchant à la fois la tumeur et les dégradations osseuses associées. » De plus, l’architecture osseuse étant conservée, nous pourrions imaginer élargir des indications incluant les métastases osseuses dans le cas des cancers de la prostate ou du sein, mais également les pathologies osseuses non tumorales (ostéoporose) ».