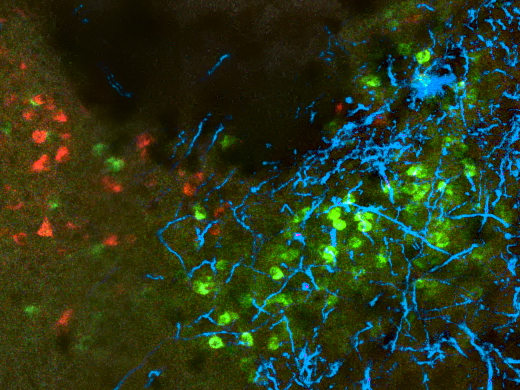
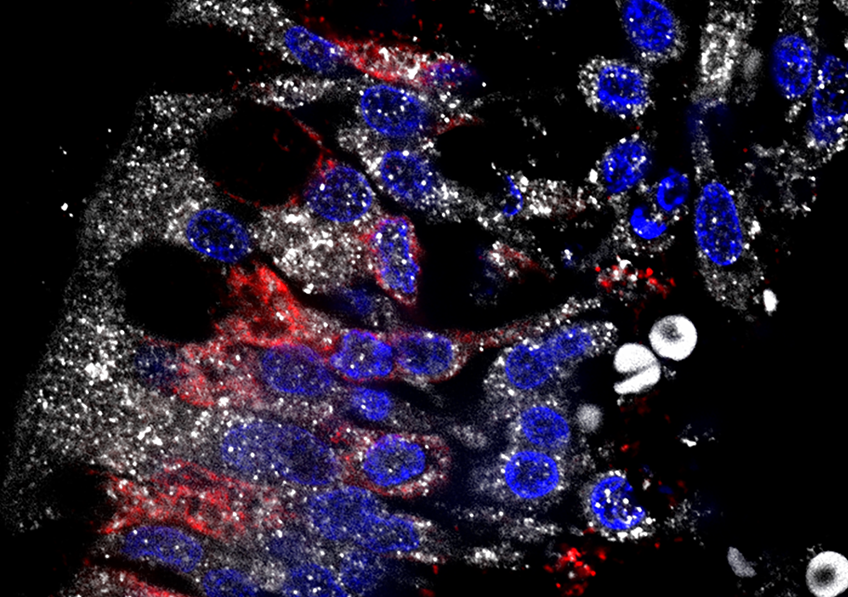
 Image illustrant l’infection par le SRAS-CoV2 (immunoréactivité pour la protéine S en blanc) dans les neurones olfactifs exprimant la protéine marqueur olfactive (OMP, en rouge) dans l’épithélium nasal humain. ©Vincent Prévot/Inserm
Image illustrant l’infection par le SRAS-CoV2 (immunoréactivité pour la protéine S en blanc) dans les neurones olfactifs exprimant la protéine marqueur olfactive (OMP, en rouge) dans l’épithélium nasal humain. ©Vincent Prévot/Inserm
Les conséquences sur le cerveau d’une infection par le SARS-CoV-2, responsable de la Covid-19 sont de plus en plus documentées par la littérature scientifique. Des chercheurs et chercheuses de l’Inserm, du CHU de Lille et de l’Université de Lille, au sein du laboratoire Lille neuroscience et cognition, en collaboration avec leurs collègues de l’Imperial College London, se sont intéressés plus spécifiquement aux conséquences de cette infection sur une population précise de neurones connue pour réguler la reproduction sexuelle via l’hypothalamus (les neurones exprimant l’hormone GnRH). Leurs résultats, suggèrent que l’infection peut entraîner la mort de ces neurones et être à l’origine de certains symptômes qui persistent dans le temps. Les résultats de cette étude sont publiés dans la revue eBioMedicine.
De nombreuses études scientifiques ont documenté les conséquences sur le cerveau d’une infection au SARS-CoV-2. Parmi les effets qui ont été identifiés, une proportion significative d’hommes présente des taux de testostérone faibles qui persistent dans le temps. Au-delà de quatre semaines, on peut parler alors de « Covid long ».
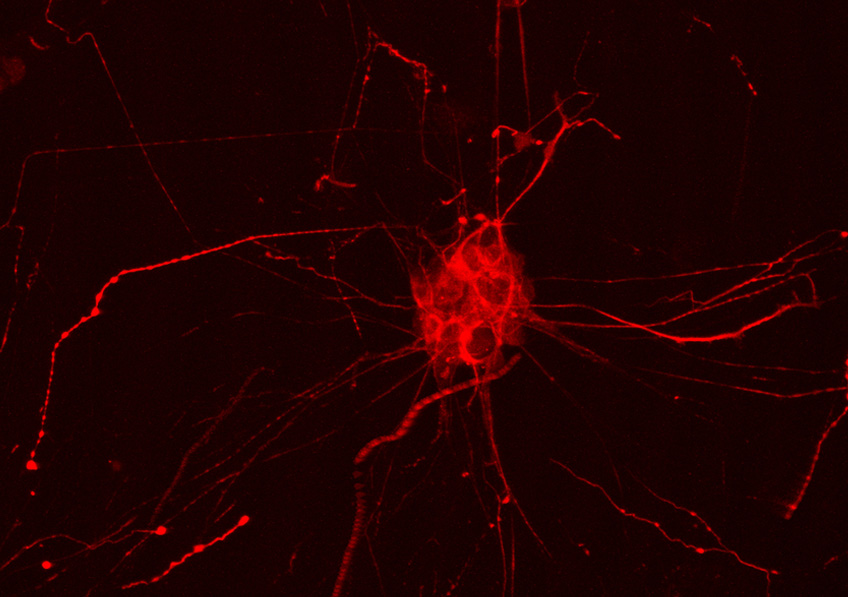
Une équipe de recherche de l’Inserm, du CHU et de l’Université de Lille, étudie depuis de nombreuses années le rôle de certains neurones exprimant une hormone appelée GnRH (Gonadotropin-Releasing Hormone). Ces neurones contrôlent depuis l’hypothalamus tous les processus associés aux fonctions reproductrices : la puberté, l’acquisition des caractères sexuels secondaires et la fertilité à l’âge adulte.
Ces mêmes scientifiques avaient par exemple précédemment identifié qu’un dysfonctionnement des neurones à GnRH dans un modèle animal de la trisomie 21, pouvait avoir des conséquences sur l’altération des fonctions cognitives associées à cette maladie.
Dans une nouvelle étude, ils ont voulu tester l’hypothèse selon laquelle une infection par le SARS-CoV-2 peut avoir des conséquences délétères sur cette population de neurones régulateurs de la reproduction.
Le virus pénètre les neurones à GnRH et altère leurs fonctions
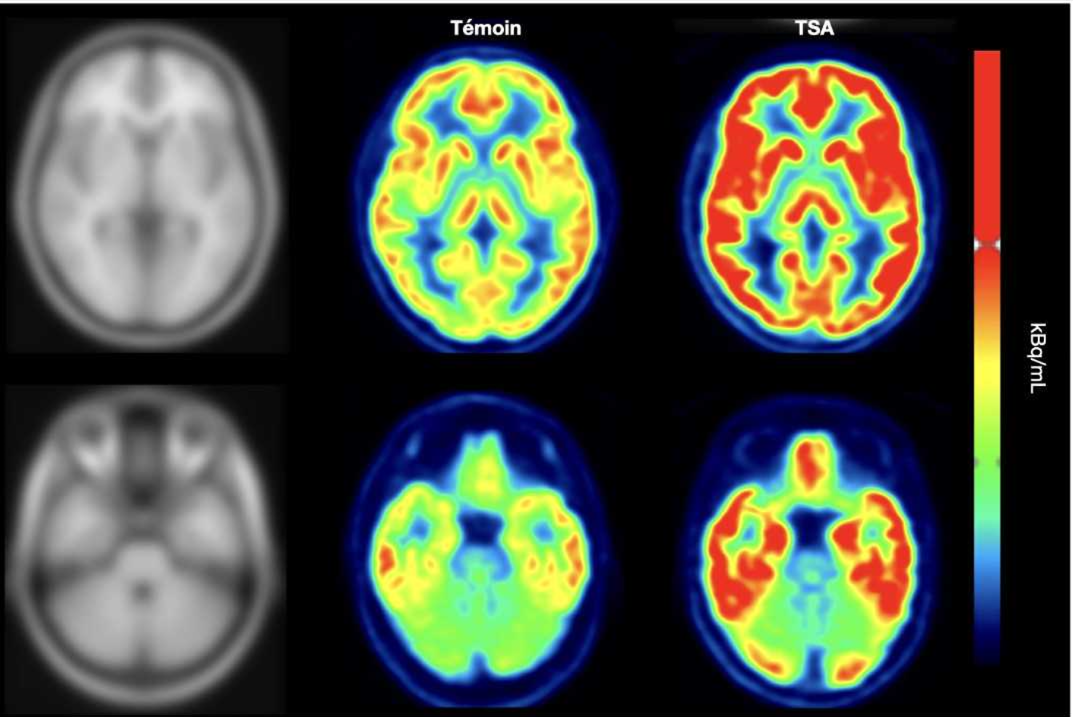
En s’appuyant sur les dosages hormonaux (testostérone et LH) réalisés trois mois et un an après l’infection chez un petit groupe de 47 hommes[1], les scientifiques ont constaté que le contact avec le virus pouvait altérer les fonctions des neurones à GnRH, entraînant une chute du taux de testostérone chez certains patients quelques temps après l’épisode infectieux.
Les scientifiques ont ensuite voulu vérifier si l’infection des neurones à GnRH et les anomalies hormonales observées après l’infection pouvaient être associées à des déficits cognitifs. Ils ont pour cela répertorié les symptômes cognitifs rapportés par les patients de la cohorte, qui ont subi des tests approfondis à 3 mois, puis 1 an après l’infection. Résultats : la proportion de patients signalant des troubles de la mémoire ou de l’attention, quelle que soit leur fréquence ou leur gravité, mais aussi des difficultés de concentration, avait tendance à être légèrement plus élevée chez les patients qui présentaient des dosages hormonaux anormaux, caractérisés par une baisse du taux de testostérone.
« Bien qu’il s’agisse de mesures effectuées sur un petit échantillon de patients et uniquement masculins, ces résultats sont très intéressants et mériteraient d’être approfondis dans le cadre d’autres études menées à plus grande échelle », explique Waljit Dhillo, professeur à l’Imperial College London, co-dernier auteur de cette étude.
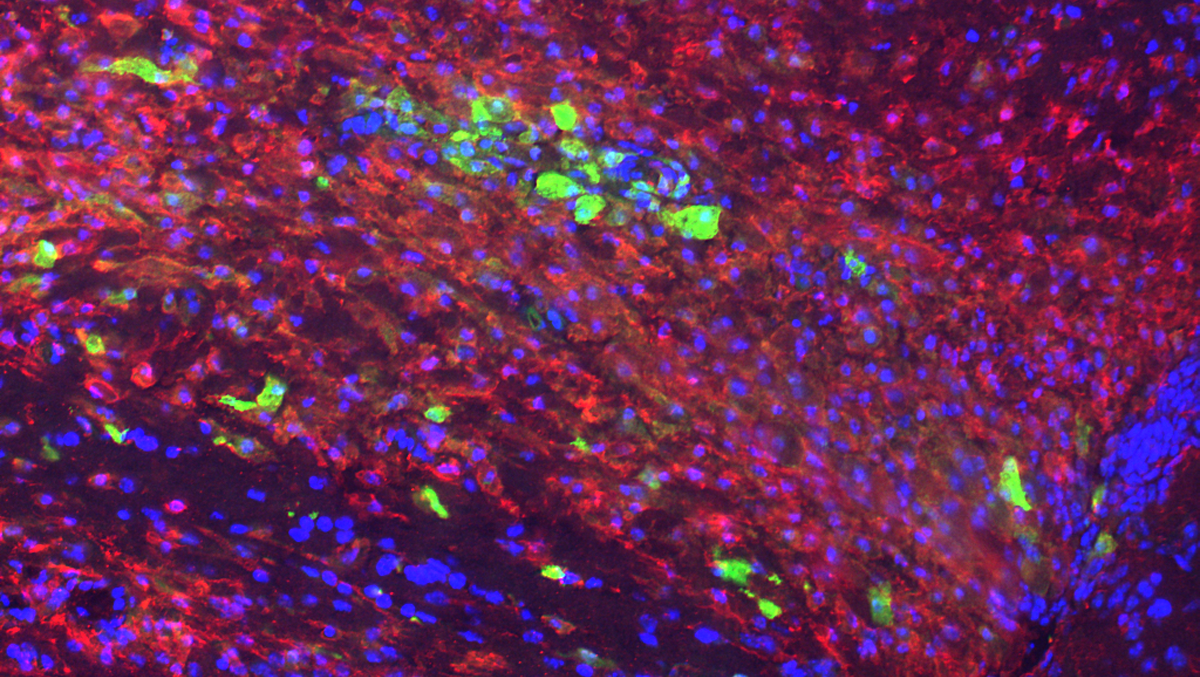
Pour compléter leurs analyses, les chercheurs ont enfin étudié le cortex de patients décédés des suites de la Covid-19. Ils ont identifié la présence du virus au niveau de l’hypothalamus et ont constaté la mort d’une partie de la population de neurones à GnRH.
« Ces résultats peuvent être inquiétants sur plusieurs points au regard du rôle de ces neurones dans la reproduction et de leur implication dans certaines fonctions cognitives. Ils pointent la nécessité d’optimiser et de généraliser le suivi médical des personnes atteintes de symptômes persistants suite à une infection par la Covid-19 », conclut Vincent Prévot, directeur de recherche à l’Inserm, co-dernier auteur de cette étude.
L’étude incite aussi à poursuivre les travaux sur les conséquences neurologiques du Covid long.
Ce projet de recherche a bénéficié d’un financement de l’ANRS-MIE.
[1]Ces données ont été collectées dans le cadre d’une étude plus large évaluant les fonctions surrénaliennes et thyroïdiennes après une infection par le Sars-CoV-2 : https://pubmed.ncbi.nlm.nih.gov/34008009/