Les médecins doivent repenser la façon dont ils traitent les patients qui ont subi une hémorragie cérébrale, la forme la plus mortelle d’AVC, selon les constatations issues d’une
étude clinique. L’étude suggère une modification des recommandations pour le traitement des patients qui ont eu un AVC causé par des saignements dans le cerveau – connu comme une hémorragie intracérébrale (HIC) – alors qu’il prenaient régulièrement de l’aspirine.
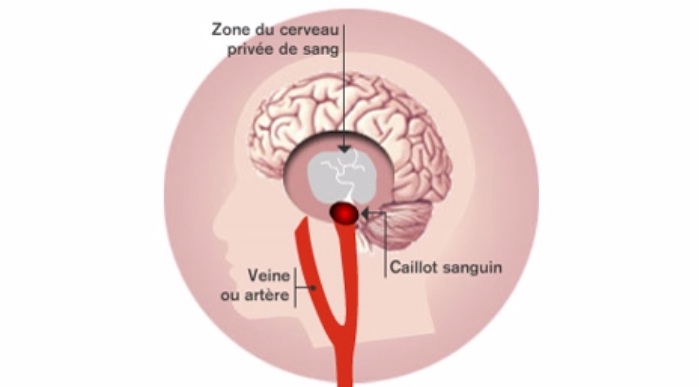 Accident vasculaire cérébral ischémique (AVC)
Accident vasculaire cérébral ischémique (AVC)
(c) Inserm/Koulikoff Frédérique
Lors d’un AVC hémorragique, la transfusion de plaquettes est un traitement jusqu’à lors utilisé par un certain nombre de médecins dans l’espoir d’une meilleure récupération de l’état de santé du patient. En effet, il était imaginé que les plaquettes – fragments de cellules sanguines jouant un rôle essentiel dans la coagulation du sang – pouvaient bloquer les vaisseaux sanguins rompus et ainsi prévenir l’aggravation du saignement dans le cerveau chez les patients qui utilisent par ailleurs, des anti-agrégants plaquettaires (aspirine).
Une équipe de chercheurs de France (Lille), des Pays-Bas, et du Royaume-Uni a constaté que la transfusion de plaquettes réduisait la chance de récupération chez les patients ayant subi une hémorragie intracérébrale tout en prenant de l’aspirine.
Le Professeur Charlotte Cordonnier (PU-PH au CHU de Lille, à l’Université de Lille et au sein de l’Unité Inserm 1171) ajoute « Chaque année, environ deux millions d’adultes dans le monde souffrent d’AVC causé par une hémorragie intracérébrale, ce qui représente la moitié des décès survenus du fait d’un AVC. Deux personnes sur cinq meurent dans le mois, et deux autres sur cinq deviennent dépendants de leurs proches. Un quart des patients sont sous aspirine au moment où survient l’hémorragie cérébrale ».
Les patients AVC qui ont participé à l’essai clinique ont bénéficié d’une prise en charge standard en matière d’AVC, l’étude ayant consisté à un tirage au sort (randomisation) de deux groupes :
l’un des groupes de patients, recevant une transfusion de plaquettes et l’autre groupe de patients ne bénéficiant d’aucun traitement supplémentaire. Les chercheurs ont ainsi pu constater que les transfusions de plaquettes augmentent le risque de décès et d’invalidité à long terme par rapport à une prise en charge classique sans transfusion.
A ce jour, l’équipe de recherche indique que les causes liées à ces constatations ne sont pas connues. Ils suggèrent que le traitement puisse causer des caillots sanguins pour former ou déclencher l’inflammation dans le cerveau et l’aggravation des saignements.
Le Professeur Rustam Al-Shahi Salman de l’Université d’Édimbourg, co-directeur de l’étude, a déclaré «Notre étude montre que la transfusion de plaquettes semble nuisible, et n’est certainement pas bénéfique, pour les personnes qui prennent de l’aspirine et ont un AVC causé par des saignements dans le cerveau. Ces résultats devraient modifier les directives et recommandations cliniques ».
Les résultats de l’étude ont été présentés à l’European Stroke Organisation Conference » et sont actuellement publiés dans The Lancet.