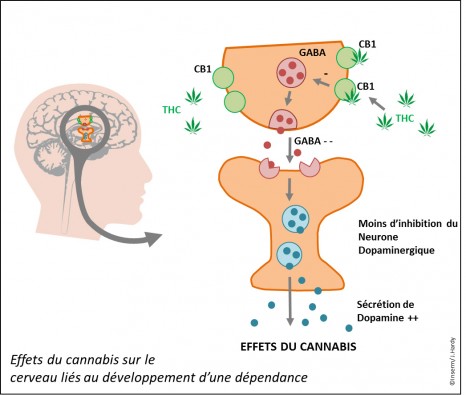
Une équipe franco-anglaise (AP-HP, Inserm, UPEC, CEA/Mircen, Oxford Biomedica, Cambridge University) a mené une étude clinique de phase 1/2 de thérapie génique chez des patients souffrant d’une forme évoluée de la maladie de Parkinson. Quinze patients ont pu bénéficier de ce nouveau traitement consistant à injecter un vecteur exprimant les gènes de trois enzymes indispensables à la biosynthèse de dopamine, qui fait défaut dans la maladie de Parkinson. Grâce à cette thérapie, certaines cellules dans le cerveau se mettent de nouveau à fabriquer et à sécréter la dopamine. Chez tous les patients, les symptômes moteurs de la maladie ont été améliorés jusqu’à 12 mois après l’administration du traitement.
Avec un recul de 4 ans, cette étude démontre à ce stade l’innocuité et la tolérance du vecteur lentiviral utilisé pour la première fois chez l’homme. Cette étude a été coordonnée par le Pr Stéphane Palfi, chef du service de neurochirurgie de l’hôpital Henri-Mondor (AP-HP). Elle fait l’objet d’une publication dans The Lancet.
Ecouter les explications du Professeur Palfi (durée 15 min)

repérage des cibles en téléradiographie – © AP-HP
Parkinson, une maladie neurodégénérative fréquente
Avec environ 120 000 patients en France, la maladie de Parkinson est l’affection neurologique dégénérative la plus fréquente après la maladie d’Alzheimer. Elle se traduit essentiellement par des symptômes moteurs de sévérité progressive et croissante, tels que des tremblements, une rigidité des membres et une diminution des mouvements du corps. Cette pathologie est due à la dégénérescence des neurones produisant la dopamine, un neurotransmetteur intervenant dans le contrôle de la motricité. Actuellement, le traitement des personnes atteintes de cette maladie consiste à prendre des médicaments mimant l’action de la dopamine manquante dans le cerveau de ces patients. Si ce traitement permet d’obtenir une bonne amélioration de l’activité motrice dans les premiers stades de la maladie, des effets indésirables sévères apparaissent au fils du temps : fluctuations de l’effet du traitement et mouvements anormaux involontaires, appelés dyskinésies.
Développer un nouveau traitement permettant une restitution physiologique de la dopamine manquante
Depuis quelques années, les experts de la maladie de Parkinson, chercheurs et médecins, ont émis l’hypothèse que la prise intermittente de médicaments dans la journée altère le fonctionnement du cerveau en stimulant de manière trop irrégulière les neurones. Ce phénomène serait à l’origine des complications du traitement dopaminergique.
Les enjeux actuels du traitement de la maladie de Parkinson consistent donc à développer une technologie qui permettrait d’induire :
· une stimulation dopaminergique continue ;
· une stimulation dopaminergique locale afin d’induire des effets moteurs bénéfiques tout en évitant les complications consécutives à la stimulation dans d’autres régions du cerveau non atteintes par la maladie de Parkinson.
C’est pourquoi, aujourd’hui, les chercheurs se tournent vers la thérapie génique, qui consiste à faire exprimer directement un gène thérapeutique par les cellules du cerveau.
Les travaux du Pr Palfi : augmenter la synthèse de dopamine par thérapie génique
Dans la majorité des cas, la maladie de Parkinson n’est pas d’origine génétique. Cependant, les modifications biochimiques responsables des symptômes peuvent être corrigées par une stratégie de thérapie génique de type « remplacement ou restauration de fonction » pour augmenter la synthèse de dopamine (par expression des gènes impliqués dans la biosynthèse de la dopamine) et restaurer en partie la fonction des cellules dopaminergiques. C’est cette approche qui a été adoptée dans l’étude biomédicale de phase I/II coordonnée par le Pr Stéphane Palfi (hôpital Henri- Mondor, AP-HP), dont les résultats viennent d’être publiés. Quinze patients ont été opérés par le Pr Palfi, investigateur coordonnateur, dans 2 centres d’excellence de neurochirurgie : l’hôpital Henri Mondor (AP-HP) en France et l’hôpital Addenbrookes à Cambridge, au Royaume-Uni.
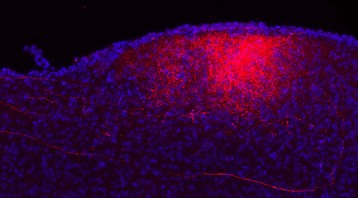
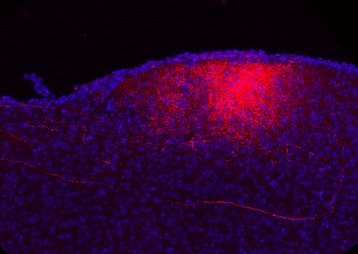
Pour la 1ère fois chez l’homme, l’équipe a utilisé un vecteur lentiviral 1, qui exprime les gènes de trois enzymes – AADC (décarboxylase des acides aminés aromatiques), TH (tyrosine hydroxylase) et CH1 (GTP-cyclohydrolase 1) – indispensables à la biosynthèse de la dopamine.
Le produit a été administré dans la région du cerveau appelée le striatum lors d’une opération chirurgicale lourde.
Une fois au bon endroit, les gènes contenus dans le lentivirus peuvent s’exprimer et reprogrammer des cellules qui se mettent à fabriquer et à sécréter de la dopamine dans le milieu extracellulaire. Trois niveaux de doses croissantes (1x, 2x et 5x) ont été testés.
La production de dopamine in vivo de façon locale et continue a été restaurée chez les 15 patients souffrant d’une forme évoluée de cette maladie.
Le suivi sur le long terme de ces patients (4 ans) a mis en évidence l’innocuité, la tolérance et des signes d’efficacité thérapeutique du vecteur viral indéniables et dépendant de la dose administrée : la plus forte dose de vecteur induisant des effets thérapeutiques plus importants.
« Cette étude biomédicale de thérapie génique montre l’innocuité sur le long terme du transfert de gènes par le vecteur lentiviral lorsqu’il est injecté directement dans le cerveau de patients atteints par la maladie de Parkinson » explique le Pr Stéphane Palfi. « L’analyse clinique suggère que le vecteur utilisé permet une réduction des symptômes moteurs selon la dose de vecteur administrée, la plus forte dose étant la plus efficace. Les prochains développements cliniques du vecteur auront pour objectifs de valider une construction virale améliorée permettant d’induire une libération accrue de dopamine (phase 2a). Cette phase sera suivie de l’étude de l’effet thérapeutique de ProSavin® en comparant un groupe de patients traités à un autre groupe non traité (phase 2b). Cette étude pionnière de l’utilisation en thérapie génique d’un lentivirus injecté in-situ va certainement ouvrir de nouvelles perspectives thérapeutiques dans les maladies du système nerveux. »
Des recherches entamées en 2009
Cet essai clinique fait suite à une étude préclinique publiée en 2009, qui avait montré pour la première fois l’efficacité et l’innocuité du médicament chez un modèle animal. Réalisée au sein de la plateforme translationnelle MIRCen du CEA, elle a ouvert la voie à l’étude clinique de ProSavin®.
La thérapie génique consiste à introduire des gènes thérapeutiquesin vivo afin qu’ils s’expriment directement dans les cellules ciblées. Elle repose sur l’utilisation des vecteurs viraux, tels que les lentivirus, les adénovirus et les AAV (« adeno-associated virus », qui ont la capacité d’introduire leur matériel génétique dans le noyau des cellules hôtes. Plusieurs exigences doivent être absolument satisfaites pour qu’un virus sauvage puisse être transformé en vecteur capable d’assurer un transfert de gènes d’intérêt thérapeutique en toute sécurité : ces enveloppes virales sont débarrassées de leurs propriétés de multiplication et rendues non pathogènes.