Les aires cérébrales liées au langage se seraient étendues chez nos ancêtres dans des périodes d’explosion technologique, au moment où l’usage d’outils devenait plus répandu. © Adobe Stock
Notre capacité à comprendre la syntaxe de certaines phrases complexes fait partie des compétences langagières les plus difficiles à acquérir. En 2019, des travaux avaient révélé une corrélation entre le fait d’être particulièrement habile dans le maniement d’outils et d’avoir de bonnes compétences syntaxiques. Une nouvelle étude, menée par des chercheurs et chercheuses de l’Inserm, du CNRS et de l’Université Claude Bernard Lyon 1 et l’Université Lumière Lyon 2, en collaboration avec le Karolinska Institutet en Suède, montre désormais que ces deux habiletés font appel à de mêmes ressources cérébrales, localisées dans la même région du cerveau. Par ailleurs, un entraînement moteur avec un outil améliore nos capacités à comprendre la syntaxe de phrases complexes et à l’inverse, un entrainement syntaxique améliore les performances d’utilisation d’outils. Dans le domaine clinique, ces résultats pourraient être exploités pour soutenir la rééducation de patients ayant perdu une partie de leurs compétences langagières. L’étude est publiée dans la revue Science.
Le langage a longtemps été considéré dans le domaine des neurosciences comme une habileté très complexe, mobilisant des réseaux cérébraux spécifiquement dédiés à cette faculté. Cependant, depuis plusieurs années, des travaux scientifiques ont réexaminé cette idée.
Des études ont ainsi suggéré que des zones du cerveau qui contrôlent certaines fonctions langagières, comme le traitement du sens des mots par exemple, sont également impliquées dans le contrôle de la motricité fine. Toutefois, aucune preuve fondée sur l’imagerie cérébrale n’a permis de révéler de tels liens entre langage et utilisation d’outil. La paléo-neurobiologie[1] a indiqué que les aires cérébrales liées au langage se seraient étendues chez nos ancêtres dans des périodes d’explosion technologique, au moment où l’usage d’outils devenait plus répandu.
En considérant ces données, des équipes de recherche se sont donc interrogées : et si l’usage de certains outils, qui suppose de réaliser des mouvements complexes, impliquait des ressources cérébrales similaires à celles mobilisées dans des fonctions langagières complexes comme la syntaxe?
Exercices de syntaxe et maniement d’une pince
En 2019, le chercheur Inserm Claudio Brozzoli en collaboration avec la chercheuse CNRS Alice C. Roy et leur équipe a montré que des individus particulièrement habiles dans l’utilisation d’outils étaient aussi généralement plus performants dans le maniement des subtilités de la syntaxe suédoise.
Pour aller plus loin, la même équipe en collaboration avec la chercheuse CNRS Véronique Boulenger[2], a mis au point toute une série d’expériences en s’appuyant sur des techniques d’imagerie cérébrale (imagerie par résonance magnétique fonctionnelle ou IRM) et des mesures du comportement. Les participants ont été invités à réaliser plusieurs tests consistant en un entraînement moteur avec une pince mécanique et des exercices de syntaxe en français. Cela a permis aux scientifiques d’identifier les réseaux cérébraux spécifiques à chaque tâche, mais aussi communs aux deux tâches.
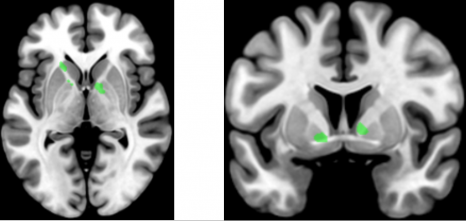
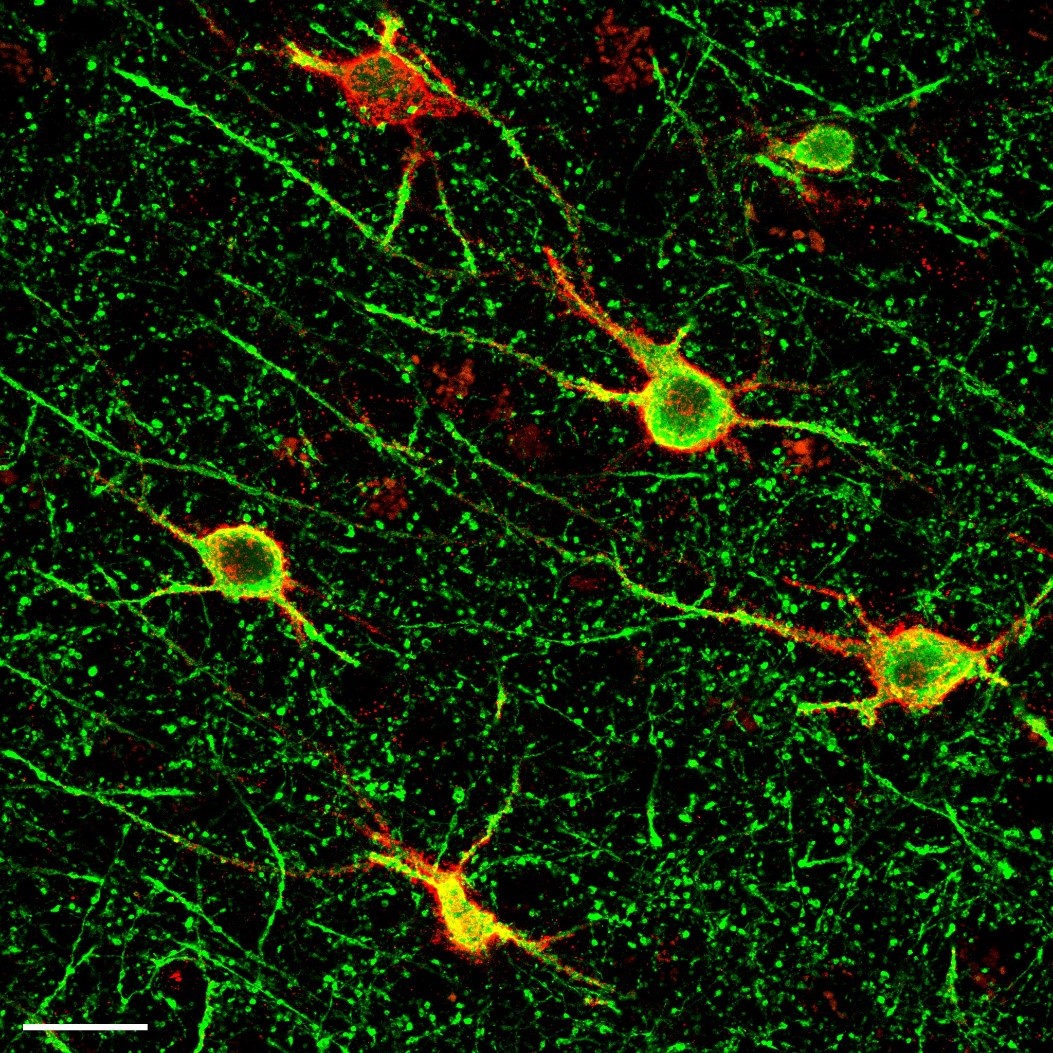
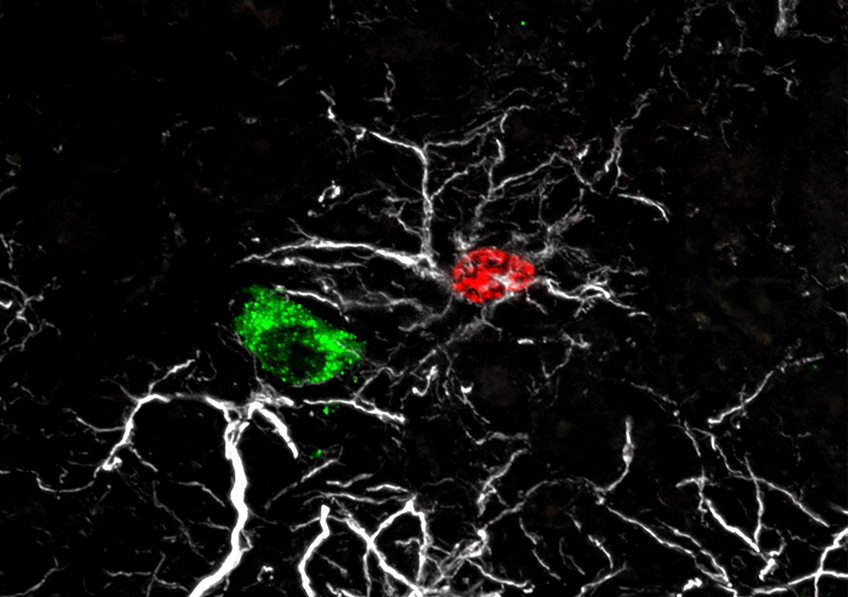
Le maniement de la pince et les exercices de syntaxe proposés aux participants produisaient des activations dans une région appelée « ganglions de la base ». © Claudio Brozzoli
« Le choix de la pince et non d’un autre objet n’est pas un hasard. En effet, il s’agit d’un outil qui permet un mouvement sophistiqué, dans lequel interviennent des paramètres comme la distance parcourue pour rejoindre l’objet que l’on veut attraper, l’ouverture « des doigts » de la pince et l’orientation, et que l’on peut donc comparer en termes de complexité au maniement de la syntaxe dans le langage », explique Claudio Brozzoli.
À travers les différentes expériences, les scientifiques ont observé pour la première fois que le maniement de la pince et les exercices de syntaxe proposés aux participants produisaient des activations cérébrales dans des zones communes, avec une même distribution spatiale, dans une région appelée « ganglions de la base ».
Entraînement cognitif
Si ces deux types d’habiletés utilisent les mêmes ressources cérébrales, est-il possible d’en entraîner une pour améliorer l’autre ? Un entraînement moteur avec la pince mécanique permet-il d’améliorer la compréhension de phrases complexes ? Dans la seconde partie de leur étude, les scientifiques se sont intéressés à ces questions et ont montré que c’est bien le cas.
Les participants ont cette fois été invités à réaliser une tâche de compréhension syntaxique avant et après un entraînement moteur de 30 minutes avec la pince (voir encadré pour le détail de l’expérience). Les chercheurs et chercheuses ont ainsi démontré que l’entraînement moteur avec la pince s’accompagne d’une amélioration des performances dans les exercices de compréhension syntaxique.
Par ailleurs, les résultats obtenus soulignent que l’inverse est également vrai : un entraînement des facultés langagières, avec des exercices de compréhension de phrases à la structure complexe, améliore les performances motrices avec une pince mécanique.
Entraînement moteur et exercices de syntaxe
L’entraînement moteur consistait à insérer avec la pince de petits pions dans des trous adaptés à leur forme mais avec des orientations variables.
L’exercice de syntaxe réalisé avant et après cet entraînement consistait à lire des phrases à la syntaxe simple comme « Le scientifique qui admire le poète rédige un article » ou à la syntaxe plus complexe comme « Le scientifique que le poète admire rédige un article ». Ensuite, les participants devaient juger comme vraies ou fausses des affirmations du type : « Le poète admire le scientifique ». Les phrases comportant le pronom relatif objet « QUE » sont plus difficiles à traiter et les performances étaient donc généralement moins bonnes pour ce type de phrases.
Ces expériences ont révélé qu’après l’entraînement moteur, les participants présentaient de meilleures performances avec les phrases considérées plus difficiles. Les groupes contrôles, qui ont réalisé la même tâche langagière mais après un entraînement moteur à main nue ou sans entraînement, n’ont pas montré une telle amélioration.
Les scientifiques réfléchissent désormais à la meilleure manière d’appliquer ces résultats dans le domaine clinique. « Nous sommes en train d’imaginer des protocoles qui pourraient être mis en place pour soutenir la rééducation et la récupération des compétences langagières de certains patients ayant des facultés motrices relativement préservées, comme par exemple des jeunes présentant un trouble développemental du langage. Au-delà de ces applications, qui pourraient se révéler innovantes, ces résultats nous donnent aussi un aperçu de la manière dont le langage a évolué dans l’Histoire. Lorsque nos ancêtres ont commencé à développer et utiliser des outils, cette habileté a profondément changé le cerveau et a imposé des demandes cognitives qui pourraient avoir amené à l’émergence de certaines fonctions comme la syntaxe », conclut Claudio Brozzoli.
[1] Champ d’étude dans lequel les scientifiques s’intéressent à l’évolution de l’anatomie du cerveau de nos ancêtres.
[2] Sont impliqués dans ces résultats le Centre de recherche en neurosciences de Lyon (Inserm/CNRS/Université Claude Bernard Lyon 1) et le laboratoire Dynamique du langage (CNRS/Université Lumière Lyon 2).