Le sang est composé de nombreuses cellules qui assurent des fonctions vitales bien précises. Lorsque le fonctionnement de ce système s’emballe, il peut être responsable de certaines formes de cancer appelées hémopathies. En 2009, des mutations d’un gène unique ont été identifiées dans 3 formes différentes d’hémopathies humaines par Olivier Bernard, chercheur à l’Inserm au sein de l’Unité 985 « Génétique des tumeurs » à l’Institut de cancérologie Gustave Roussy, et ses collaborateurs. Deux ans après, les chercheurs confirment le rôle de ce gène « suppresseur de tumeur » dans des travaux à paraitre dans la revue Cancer Cell.
Les hémopathies humaines sont des formes de cancers dues à l’accumulation d’anomalies génétiques dont certaines touchent les cellules souches hématopoïétiques, ces cellules qui vont donner toutes les cellules sanguines.
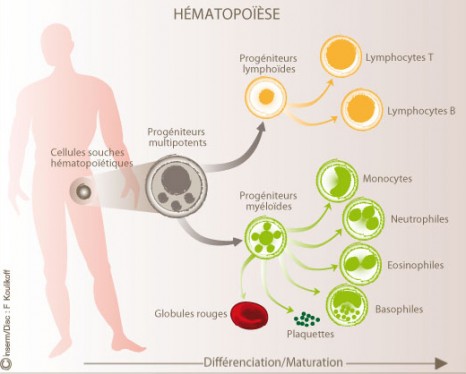
On distingue deux grands types d’hémopathies malignes :
– Les hémopathies myéloïdes, lorsque les mutations vont toucher les cellules engagées dans la voie de différenciation qui conduit aux globules rouges, aux granulocytes et aux plaquettes (en vert sur le schéma).
– Les hémopathies lymphoïdes, lorsque les mutations vont toucher les cellules engagées la voie de différenciation qui conduit aux lymphocytes B ou T(en jaune sur le schéma).
© Inserm/Disc, F. Koulikoff
En 2009, en étudiant des échantillons humains sélectionnés d’hémopathies myéloïdes, les équipes des Dr. Olivier Bernard et William Vainchenker ont identifié un gène modifié dans ces affections appelé TET2. Il restait à comprendre de quelle manière il fonctionnait et quelle était son implication précise dans la biologie des cellules souches hématopoïétiques et dans la production des cellules du sang Deux années supplémentaires ont permis aux chercheurs de répondre à cette question.
Dans ce nouveau travail publié dans la revue Cancer Cell, Olivier Bernard a généré deux lignées de souris chez lesquelles l’expression du gène TET2 a été modifiée. Les souris déficientes pour Tet2 présentent une quantité supérieure à la normale de cellules hématopoïétiques immatures, c’est-à-dire non encore engagées dans les voies de différenciation décrites dans le schéma ci-dessus. Avec le temps, ces souris développent des hémopathies myéloïdes qui ressemblent aux leucémies humaines.
En parallèle, l’analyse des échantillons humains, cette fois-ci ceux d’hémopathies lymphoïdes, montrent qu’il existe également des mutations de TET2, principalement dans les échantillons provenant d’hémopathies lymphoïdes affectant les lymphocytes T. Ces mutations peuvent survenir dans une cellule hématopoïétique très immature (multipotente).
Ces résultats confirment qu’une inactivation de la fonction du gène TET2 entraine le développement de tumeurs. Les chercheurs de l’Inserm viennent donc d’identifier un nouveau gène suppresseur de tumeur. Sa perte de fonction, et même une simple variation de son activité, prédispose au développement d’hémopathies malignes
.« Nos observations indiquent que les stratégies thérapeutiques devront à l’avenir tenter de cibler les cellules souches hématopoïétiques pour éradiquer ces maladies. On peut par exemple espérer que la restauration de la fonction de TET2 dans des cellules souches hématopoïétiques puisse être une nouvelle solution thérapeutique dans une grande proportion d’hémopathies malignes. » conclut Olivier Bernard. Rendez-vous dans deux ans ?
Ces travaux ont bénéficié d’un soutien financier de l’Inserm, de l’Institut National du Cancer (INCa), de la Ligue Nationale Contre le Cancer (LNCC), de l’Association de Recherche contre le Cancer (ARC) et de la Fondation Gustave Roussy.