L’infertilité touche plusieurs millions de couples dans le monde ; en Europe, les experts prédisent qu’elle doublera ces dix prochaines années. Un nouvel acteur dans le contrôle de la fertilité vient d’être identifié, sa défaillance provoquant immanquablement un retard pubertaire ou une hypofertilité chez l’animal. C’est la conclusion à laquelle sont arrivés Vincent Prévot chercheur à l’Inserm et ses collaborateurs de l’Unité 837 « Centre de recherche Jean Pierre Aubert(Inserm / Université Lille 2 Droit et Santé) ». En effet, il s’avère qu’une hormone, la prostanglandine E2, libérée par les cellules gliales (1) dans l’environnement des neurones est indispensable pour déclencher toute la cascade conduisant à l’activation des fonctions de reproduction. Ces travaux publiés le 5 septembre 2011 dans le journal PNAS sont peut-être un premier pas dans le traitement des troubles de la fertilité d’origine centrale (aménorrhée d’origine hypothalamique, retard pubertaire, puberté précoce).

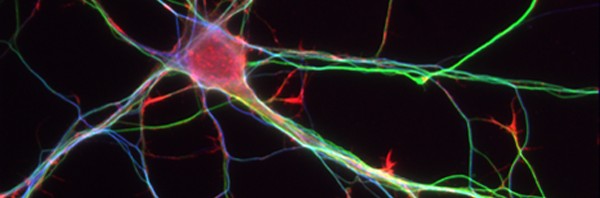
La fonction de reproduction est déterminée par des événements qui prennent place dans le cerveau. Au moment de la puberté, l’activation d’une poignée de neurones très spécialisés (les neurones à GnRH), localisés dans l’hypothalamus, conduit à une sécrétion pulsatile de gonadolibérine ou GnRH (Gonadotropin Releasing Hormone).
La sécrétion de GnRH stimule la synthèse et la libération d’hormone lutéinisante (LH) et d’hormone folliculostimulante (FSH). Ces hormones sont alors libérées dans la circulation générale pour promouvoir la croissance des organes sexuels secondaires au moment de la puberté. Elles fonctionnent ensuite tout au long de la vie pour assurer la fonction reproductive.
Depuis quelques années, les chercheurs pensaient que les neurones à GnRH recevaient des informations émanant de neurones situés dans leur environnement proche pour fonctionner. L’activation de ces neurones voisins constituerait l’élément déclencheur de l’augmentation de la sécrétion de GnRH nécessaire à la survenue de la puberté et de la fertilité.
Vincent Prévot, chercheur à l’Inserm et ses collaborateurs viennent de prouver que la libération d’une hormone (la prostaglandine E2 ou PGE2) par les cellules gliales est indispensable à l’activité électrique des neurones à GnRH. Ainsi l’activation de ces derniers dépendrait non seulement de l’activité électrique d’autres neurones mais aussi d’une hormone présente dans l’environnement glial des neurones.
Un dialogue nécessaire entre cellules gliales et neurones
La PGE2 située dans les cellules gliales (astrocytes) a un puissant effet excitateur sur l’activité électrique des neurones à GnRH étudiés par les chercheurs. A contrario, cette activité électrique est interrompue par l’inhibition de la synthèse de PGE2. Chez un animal avec un retard pubertaire dont les astrocytes sécrètent moins de PGE2, les neurones à GnRH n’ont pas d’activité électrique mesurable. L’ajout de PGE2 dans le milieu rétablit l’activité électrique du neurone et les fonctions de reproduction. Un nouvel acteur dans le contrôle de la fertilité vient donc d’être identifié, sa défaillance provoquant immanquablement retard pubertaire ou hypofertilité. Pour Vincent Prévot, « l’identification de cette hormone, en plus de dévoiler un rôle primordial pour les cellules gliales dans le contrôle d’une grande fonction biologique chez les mammifères ouvre de nouvelles pistes thérapeutiques pour le traitement des troubles de la fertilité ».
Note
(1) Les cellules gliales sont dix fois plus nombreuses que les neurones. Elles comblent les espaces situés entre eux, sont au contact des vaisseaux sanguins ou encore forment la gaine de myéline de certains neurones. On sait maintenant qu’elles jouent un rôle clé dans la genèse, la propagation et le traitement de l’information nerveuse.