Quelle est la relation entre la mauvaise qualité de l’air intérieur et la santé allergique et respiratoire des enfants des écoles françaises? L’équipe Epidémiologie des Maladies Allergiques et Respiratoires (EPAR) d’Isabella Annesi-Maesano, directrice de recherche Inserm dans l’unité mixte de recherche 707 « épidémiologie, systèmes d’information, modélisation » (Inserm/UPMC) vient de publier dans la revue Thoraxles résultats de son étude sur la qualité de l’air à l’intérieur de 108 écoles primaires réparties dans 6 villes françaises. Bien que la qualité de l’air intérieur varie en fonction des écoles et des villes, les chercheurs révèlent qu’environ 30% des 6590 enfants suivis, soit 3 enfants sur 10, sont exposés à des niveaux des principaux polluants atmosphériques supérieurs aux valeurs guides recommandées par l’OMS et l’ANSES (1). Cette exposition est associée à une augmentation de l’asthme et des rhinites chez les enfants scolarisés, les plus à risques étant les enfants allergiques.
Les enfants sont plus sensibles aux effets de la pollution de l’air que les adultes. La pollution de l’air intérieur peut entrainer chez les enfants des problèmes de santé à court et à long terme tels que la congestion nasale, des irritations de la peau et des yeux, des réactions allergiques, de l’asthme, des maux de tête, de la fatigue, des vertiges ou encore des nausées. Dans les pays industrialisés, les enfants passent environ 80% de leur temps à l’intérieur, une grande partie à l’école. Bien que des données américaines soulignent une pollution de l’air intérieur accrue dans les écoles, les relations entre cette qualité de l’air intérieur des écoles, la santé allergique et respiratoire des enfants scolarisés n’ont été que peu explorées. C’est pourquoi l’équipe EPAR d’Isabella Annesi-Maesano, directrice de recherche Inserm, a mené une étude dans six villes de France (Bordeaux, Clermont-Ferrand, Créteil, Marseille, Strasbourg et Reims) sur un large échantillon de 401 classes dans 108 écoles primaires. L’objectif de l’étude consistait à évaluer l’exposition de 6590 enfants concernés, garçons et filles âgé(e)s de 10 ans en moyenne, aux principaux polluants atmosphériques des classes et à analyser le lien avec l’asthme et les rhinites développés par les enfants scolarisés dans ces classes. L’étude montre que 30% des enfants sont exposés à des niveaux de polluants de l’air intérieur des classes supérieurs aux valeurs guides de l’OMS et de l’ANSES1, soit en moyenne 3 enfants sur 10, bien qu’ils n’y soient pas exposés de la même manière. « L’intérêt de notre étude est de disposer de données sur un nombre important d’enfants répartis sur l’ensemble des régions de France métropolitaine », explique Isabella Annesi-Maesano, directrice de recherche Inserm. Les chercheurs ont analysé pendant une année scolaire les concentrations de différents polluants atmosphériques: les particules fines de diamètre inférieur à 2,5 micromètre (PM2.5), le dioxyde d’azote (NO2) et 3 aldéhydes (formaldéhyde, acétaldéhyde et acroléine). Les particules fines et le dioxyde d’azote (NO2) proviennent essentiellement de la combustion automobile et peuvent rentrer par transfert (en ouvrant les fenêtres) à l’intérieur des locaux. Les aldéhydes sont des polluants intérieurs issus de nombreuses sources: les produits de combustion (cigarette, bougies, encens, cheminée, cuisinières à gaz), de construction et de décoration (bois, parquets stratifiés, des colles de moquettes, des papiers peints, mais également des vernis, des mousses isolantes), d’entretien (détergents, désinfectants, lingettes) et de traitement (insecticides)… En parallèle, l’équipe de recherche a étudié les signes cliniques des enfants grâce aux données recueillies lors d’une visite médicale comportant aussi un test cutané aux 11 allergènes les plus communs (acariens, chat, pollens…) et un test d’exercice permettant de détecter l’asthme à l’effort. Ces données ont été complétées par un questionnaire rempli par les parents. « L’exposition à des concentrations élevées de particules et composés organiques volatils est associée à une augmentation de la prévalence des signes cliniques de l’asthme et des rhinites chez les enfants scolarisés. Les enfants sujets aux allergies semblent les plus à risque », révèle la chercheuse. En détails, les résultats montrent que les rhinites (en particulier les rhino conjonctivites) sont associées de manière significative à des taux forts de formaldéhydes dans les classes et qu’une augmentation de la prévalence de l’asthme est observée dans les classes avec des taux élevés de particules fines PM2.5, de formaldéhyde, d’acroléine. La relation entre la mauvaise qualité de l’air et l’asthme concerne le plus souvent l’asthme de type allergique défini par le test cutané. « La mauvaise qualité de l’air intérieur pourrait à terme détériorer la santé allergique et respiratoire des enfants qui passent en moyenne 8h par jour à l’école. Il est donc important de maintenir une bonne qualité de l’air en classe. Cela permettrait de limiter les risques de développer les signes cliniques des rhinites et de l’asthme. Cette action doit être accompagnée par une surveillance stricte de l’exposition des enfants aux polluants à la maison et à l’extérieur « conclut l’équipe de recherche.
L’étude des 6 villes : contribution française à l’étude ISAAC
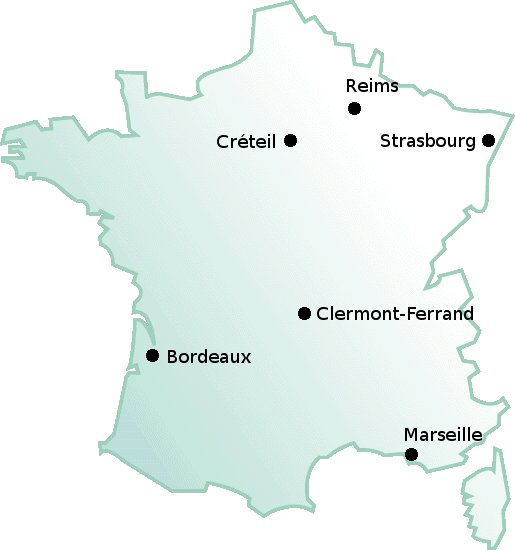
Les 6 grandes villes incluses dans l’étude ISAAC (volet français)
Objectifs spécifiques de l’Etude
L’étude International Study of Asthma and Allergies in Childhood (ISAAC) vise à mesurer la fréquence et la sévérité de l’asthme et des maladies allergiques (phase I), en déterminer les facteurs de risque (phase II) et étudier l’évolution de ces maladies (phase III). Sa partie française a été menée dans 6 grandes villes, choisies pour leurs différentes qualités de l’air (Reims, Créteil, Strasbourg, Clermont Ferrand, Bordeaux, Marseille). L’étude a inclus initialement 9615 enfants âgés en moyenne de 10 ans répartis dans 401 classes de 108 écoles. Des capteurs ont permis de mesurer l’exposition aux polluants gazeux et des pompes l’exposition aux particules à l’intérieur des locaux (salle de classe, cantine) ainsi qu’à l’extérieur (hall, préau). L’étude ISAAC a fait l’objet de plusieurs publications.
Etude européenne SINPHONIE
Une étude européenne, SINPHONIE, est actuellement en cours dans 27 pays d’Europe dont la France sur les effets de la qualité de l’air dans les écoles sur la santé au sens large des écoliers.
Santé en questions
Isabella Annesi-Maesano participera à la prochaine conférence citoyenne du cycle « santé en question » organisé par l’Inserm le 31 mai 2012 sur le thème : « Asthme chez l’enfant : quel effet de la fumée de tabac ? » au Palais de la découverte, un lieu Universcience à Paris en duplex avec Numerica à Montbéliard (25).
Notes : (1) Particules fines (PM2.5) : 10µg/m3 selon l’Organisation Mondiale de la Santé (OMS) Dioxyde d’Azote (NO2) : 40µ/m3 selon l’OMS Formaldéhydes : 10µg/m3 par an selon l’Agence nationale de sécurité sanitaire, de l’alimentation, de l’environnement et du travail (ANSES)