Une équipe de l’Institut Langevin (ESPCI, CNRS, Inserm) dirigée par Mickaël Tanter, directeur de recherche Inserm à l’ESPCI, vient de franchir une étape déterminante vers l’imagerie médicale très haute résolution utilisant des ondes ultrasonores. Les chercheurs sont parvenus à rendre compte de l’activité vasculaire du cerveau d’un rat in vivo et de manière non invasive, avec une résolution bien meilleure que n’importe quelle technique existante. Loin de l’échographe standard, la technique s’inspire plutôt de la super résolution optique (FPALM) qui avait été récompensée du Prix Nobel de Chimie 2014. Leurs travaux, publiés dans la prestigieuse revue Nature, constituent une véritable révolution pour l’imagerie biomédicale, en offrant la première technique d’imagerie microscopique permettant de voir en profondeur dans les tissus. Les applications potentielles sont immenses, de la détection précoce de tumeurs cancéreuses à d’autres pathologies cardiovasculaires et neurologiques.
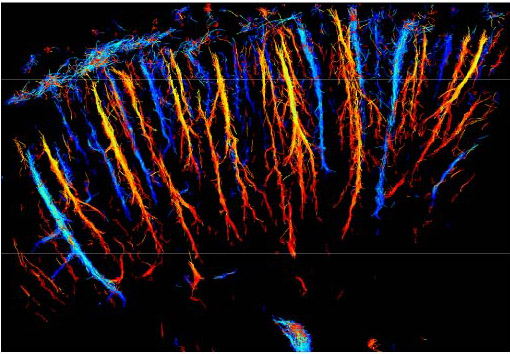
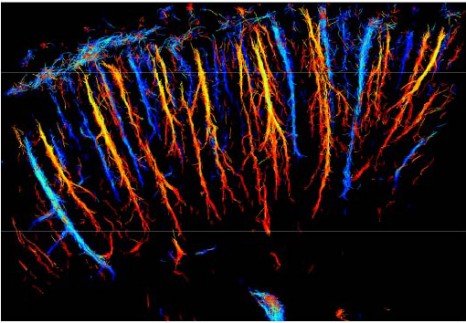
Représentation du système microvasculaire du cerveau d’un rat à partir des vitesses des bulles qui le parcourent © ESPCI / Inserm / CNRS
Accéder aux détails microscopiques de la matière vivante représente encore aujourd’hui un défi difficile à relever. Quelle que soit la technique utilisée, les chercheurs se heurtent à un obstacle de taille : plus la longueur d’onde est petite, plus l’absorption et la diffusion des ondes dans les tissus sont importantes, diminuant le pouvoir de pénétration du signal. Il faut donc choisir entre pouvoir de pénétration et résolution de l’image. Pourtant depuis une vingtaine d’années des progrès considérables ont été réalisés en imagerie par ultrasons particulièrement adaptée à l’imagerie préclinique et clinique, dont l’équipe de Mickaël Tanter est une des pionnières. Ces scientifiques ont mis au point un échographe ultra-rapide, qui équipe déjà de nombreux hôpitaux dans le monde. Mais cette fois, ils ont poussé la technique encore plus loin, atteignant une résolution spatiale inégalée en imagerie médicale : celle du micromètre (1 millième de millimètre).
Tout commence en 2009, lorsque Mickaël Tanter donne une conférence sur l’imagerie par ultrasons aux États-Unis et assiste à la présentation d’une nouvelle technique de microscopie optique à fluorescence avec une résolution meilleure que la limite de diffraction, barrière pourtant supposée infranchissable. L’invention de cette technique optique vaudra d’ailleurs à ses inventeurs le Prix Nobel de Chimie en 2014. Le chercheur français comprend que le concept des opticiens et chimistes américains, limité à une imagerie de surface, pourrait être transposé dans le monde des ondes ultrasonores en utilisant un des échographes ultrarapides de son laboratoire. Dès son retour en France, il propose à son collègue Olivier Couture, chercheur CNRS dans son équipe, de s’en inspirer pour développer leur propre technique à base d’ultrasons.
Les chercheurs décident alors d’utiliser un agent de contraste, ici des microbulles de 3 µm de diamètre déjà employées dans le domaine médical. Après plusieurs années de recherche en collaboration avec une équipe de neurobiologie (ESPCI/CNRS) dirigée par Zsolt Lenkei, directeur de Recherche Inserm, ils parviennent à injecter ces multitudes de microbulles dans une veine d’un rat. La cadence ultrarapide d’acquisition de 5000 images par seconde permet d’extraire de manière très précise le signal individuel provenant de chaque microbulle du bruit de l’ensemble des signaux rétrodiffusés. Leurs positions uniques peuvent alors être localisées individuellement par ultrasons avec une précision micrométrique lors de leur passage dans le cerveau.
En retraçant la position exacte de chaque bulle à chaque instant, les chercheurs ont réussi à reconstituer une cartographie complète du système vasculaire cérébral du rat vivant en quelques dizaines de secondes. Les détails sont tels qu’ils peuvent dissocier des vaisseaux sanguins séparés de quelques micromètres, alors que la résolution était jusqu’ici de l’ordre du millimètre et limitée par la diffraction.
Plus encore, la vitesse d’écoulement du sang est également mesurée très précisément à chaque instant avec une très grande dynamique allant de quelques dizaines de centimètres par seconde dans les gros vaisseaux jusqu’à moins d’1mm/s dans les plus petits vaisseaux du système vasculaire.
Des applications directes
Le gain en résolution est énorme, d’un facteur 20 en moyenne, d’autant plus que la technique est non invasive et rapide ce qui est très important pour le confort du patient. « Nous pensons être à l’aube d’une nouvelle révolution dans le domaine de l’imagerie médicale, confie Mickaël Tanter. En quelques dizaines de secondes, nous pouvons déjà recueillir des millions de signatures de nos microbulles et atteindre des résolutions microscopiques à plusieurs centimètres de profondeur. Nous pensons pouvoir encore accélérer cette technique pour réaliser ces images en une à deux secondes ouvrant ainsi la voie à l’imagerie fonctionnelle en super-résolution».
La technique sera prochainement évaluée sur l’homme, en particulier pour visualiser la micro-vascularisation hépatique chez des patients atteints de tumeurs du foie, ou encore pour l’imagerie trans-crânienne très haute résolution du réseau vasculaire cérébral chez l’adulte. Les applications potentielles sont très nombreuses, y compris la détection précoce de cancers dont la micro-vascularisation est à ce jour impossible à détecter. En fait n’importe quel organe pourra être imagé en 3D à l’échelle microscopique, via un appareil très peu volumineux.
Alors que la plupart des techniques actuelles de microscopie s’appuient sur des approches optiques limitées à une imagerie en surface, ce sont finalement les ultrasons qui viennent résoudre pour la première fois la question de l’imagerie microscopique en profondeur dans les organes.