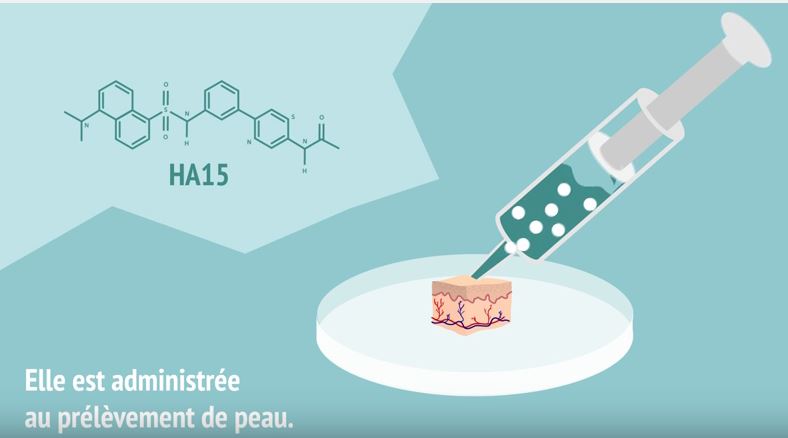
Trouver de nouveaux traitements plus efficaces et personnalisés contre le cancer est le défi de nombreux chercheurs. Pari réussi par une équipe de l’Inserm menée par Stéphane Rocchi (Unité Inserm 1065, « Centre méditerranéen de médecine moléculaire ») qui vient de synthétiser et développer de nouvelles molécules anti-mélanome. L’une d’entre elle baptisée HA15 réduit la viabilité des cellules de mélanome sans être toxique pour les cellules normales. Ce travail vient d’être publié dans la revue Cancer Cell.
Le mélanome est une forme fortement agressive de cancer de la peau. Il touche les mélanocytes, les cellules responsables de la synthèse de mélanine qui donne sa coloration à la peau. Il existe 3 stades de progression de la tumeur : la croissance radiale : les cellules prolifèrent de façon anarchique dans l’épiderme; la phase de croissance verticale implique une invasion du derme et finalement la phase métastatique correspondant à une dissémination des cellules cancéreuses dans les tissus périphériques.
Même si des résultats encourageants ont été obtenus pour traiter la phase métastatique (grâce à des thérapies ciblées ou des immunothérapies), la plupart des patients auront besoin de traitements supplémentaires pour empêcher la tumeur de revenir et les métastases de se développer à nouveau. L’identification de nouvelles molécules candidates est donc un élément incontournable pour la mise en place de biothérapies efficaces contre ce cancer dont l’incidence double tous les dix ans.
Dans ce contexte des chercheurs niçois ont découvert une nouvelle famille de molécules, les Thiazole Benzensulfonamides (TZB) présentant des propriétés anticancéreuses intéressantes. » Initialement cette famille de molécules avait été identifiée dans le diabète de type 2 car elle augmentait la sensibilité des cellules à l’insuline. Si nous voulions l’utiliser contre le cancer, il fallait pouvoir éliminer cette activité pro-insuline ». explique Stéphane Rocchi. C’est ainsi que nous avons commencé à modifier sa structure ».
Après de nombreux essais, la structure initiale de TZD a été profondément modifiée grâce à une collaboration fructueuse avec l’équipe de Dr Benhida de l’Institut de Chimie de Nice pour obtenir une formulation dont le « composé leader » a été appelé HA15.
Leurs résultats montrent que le HA15 réduit la viabilité des cellules de mélanome sans être toxique pour les cellules normales. HA15 induit un stress du réticulum endoplasmique induisant la mort des cellules de mélanome par apoptose et autophagie.
Chez la souris, cette molécule est très efficace pour diminuer le volume tumoral sans toxicité apparente chez le rongeur.
Chez l’homme, en collaboration avec le service de dermatologie du CHU de Nice, les chercheurs ont montré que les molécules étaient actives sur des cellules de mélanomes prélevées sur des biopsies de patients sensibles ou résistantes aux thérapies ciblés.
Enfin, HA15 est aussi efficace sur des lignées cellulaires provenant d’autres tumeurs comme le cancer du sein, du colon, de la prostate, du pancréas ou bien encore des gliomes ou des leucémies myéloïdes chroniques.
« Le but ultime de ce projet est d’utiliser ces nouvelles molécules dans le traitement du mélanome et plus généralement dans d’autres types de cancers. » conclut Stéphane Rocchi qui souhaite démarrer prochainement un essai clinique de phase 1.
Ce travail a fait l’objet d’un dépôt de 2 brevets par INSERM transfert, d’une présentation au programme MATWIN pour un transfert industriel et a bénéficié de financements pour de la maturation par la Canceropole PACA et par INSERM transfert (Grand COPOC).