©Inserm/Latron, Patrice
L’implication du système immunitaire dans les maladies neurologiques suggère que l’immunothérapie, qui a montré son efficacité dans le domaine du cancer et des maladies auto-immunes, a également un intérêt majeur dans le traitement des maladies neurodégénératives. C’est ce que montrent les équipes de Nathalie Cartier-Lacave (Directrice de recherche Inserm, Unité mixte Inserm-CEA 1169 « Thérapie génique, génétique, épigénétique en neurologie, endocrinologie, cardiologie et développement de l’enfant ») et de David Klatzmann (Directeur de l’Unité mixte Inserm-Université Pierre et Marie Curie 959 « Immunologie, immunopathologie, immunothérapie » et chef du service de biothérapies à l’hôpital de la Pitié-Salpêtrière, AP-HP) ) dont les travaux sont publiés ce jour dans la revue Brain. Les chercheurs ont prouvé qu’une molécule du système immunitaire appelée interleukine-2 (IL-2), est capable de contrôler l’inflammation dans les cellules du cerveau, en cause dans les maladies neurodégénératives telles que la maladie d’Alzheimer et de rétablir des fonctions cognitives altérées dans le modèle animal.
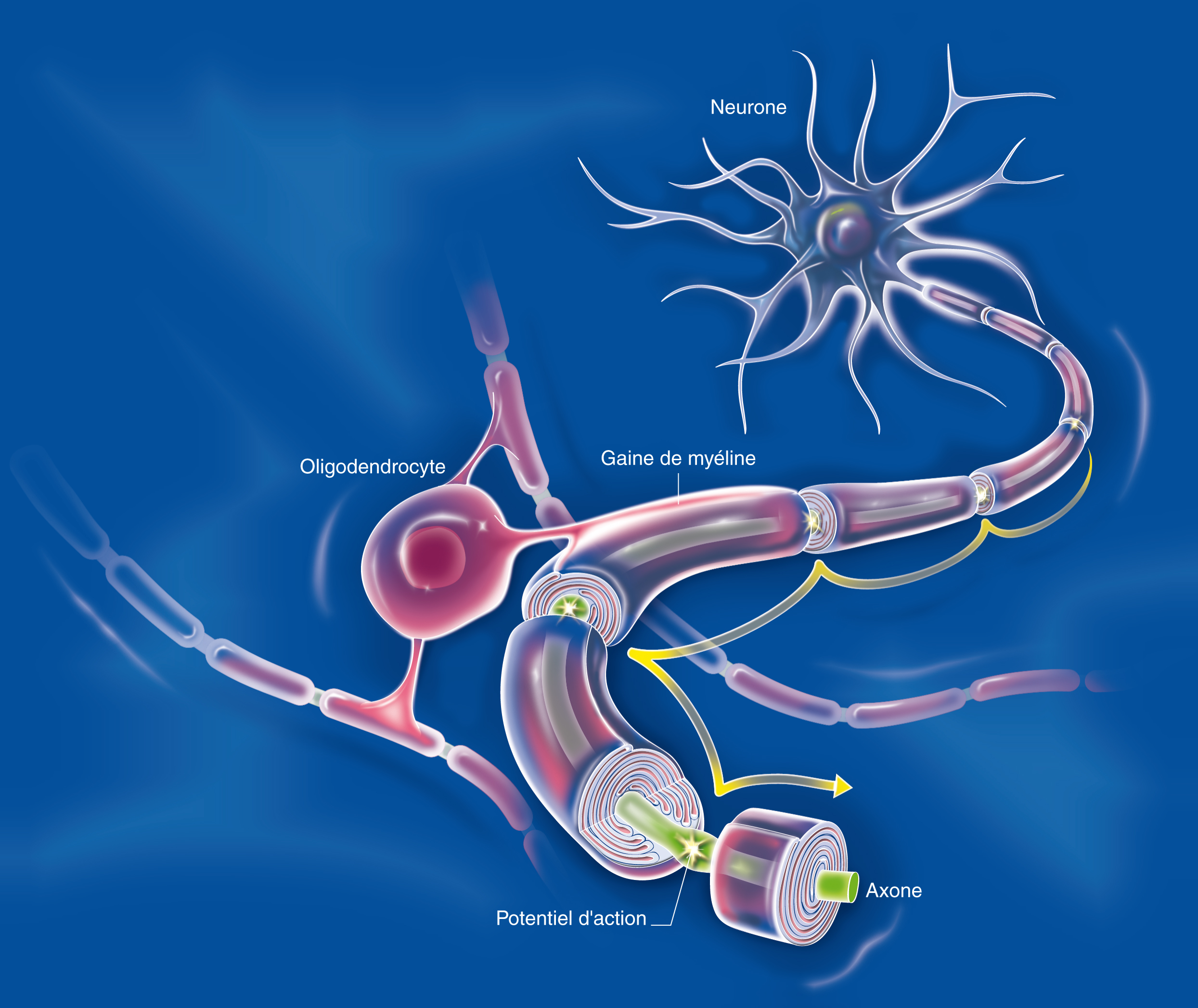
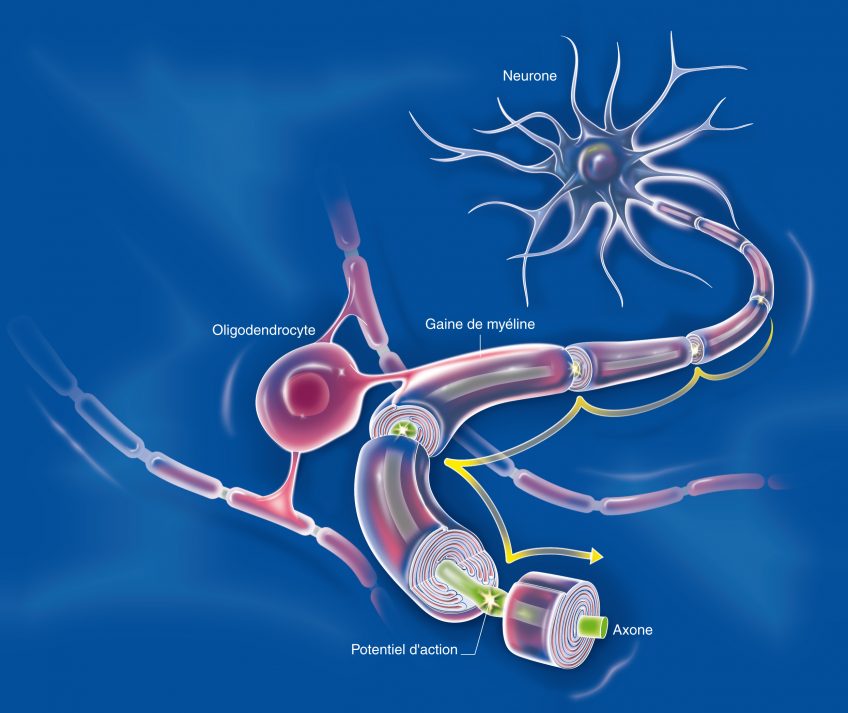
Il existe de nombreuses interactions entre le système nerveux central et le système immunitaire. Les cellules du système immunitaire circulent dans le cerveau et peuvent jouer un rôle – direct ou indirect – dans les maladies neurologiques. Ainsi, un rôle direct est démontré dans la sclérose en plaques et un rôle indirect est retrouvé à travers l’inflammation. La neurodégénérescence entraîne une neuroinflammation qui contribue à amplifier la neurodégénérescence initiale, générant un cercle vicieux qui aggrave la pathologie. Dans la maladie d’Alzheimer, le peptide amyloïde β (Aß) s’agrège dans les plaques séniles extracellulaires autour desquelles s’accumulent des astrocytes réactifs et des cellules microgliales activées. Ces cellules contribuent à dissoudre ces plaques et secrètent des cytokines qui régulent l’intensité de la réponse immunitaire du cerveau.
Or, des travaux récents ont montré que les souris déficientes en IL-2 ont des facultés d’apprentissage et de mémoire affaiblies qui rappellent la maladie d’Alzheimer (MA). De plus, l’IL-2 est actuellement en évaluation dans le traitement de plusieurs maladies auto-immunes pour sa capacité à stimuler les lymphocytes T régulateurs (Tregs) dont le rôle est de contrôler l’inflammation.
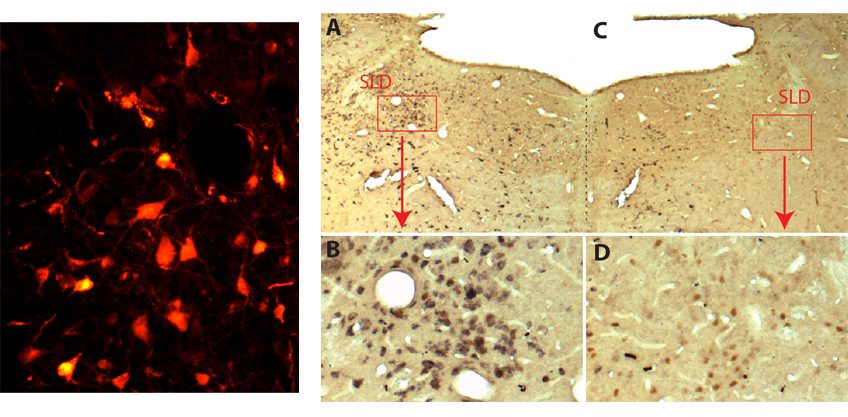
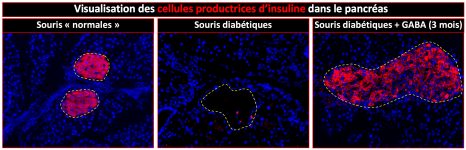
Les auteurs ont tout d’abord mis en évidence une diminution importante des taux d’IL-2 dans des biopsies cérébrales de patients décédés de la maladie d’Alzheimer. Cela les a conduits à évaluer le potentiel thérapeutique de cette molécule dans un modèle de maladie d’Alzheimer chez la souris. Les souris ont été traitées à un stade où elles avaient déjà des atteintes cérébrales. Ce traitement chronique (a induit une expansion et une activation des lymphocytes T régulateurs dans le cerveau, et entraîné une réduction des plaques amyloïdes.
Les chercheurs montrent que cette diminution de la « charge » amyloïde s’accompagne d’un important remodelage tissulaire marqué par une amélioration de la structure et de la fonction des synapses. Cette amélioration est synonyme de récupération des déficits de mémoire.
Alors que les souris non traitées échouaient dans les tests de mémoire, les souris traitées avaient des résultats comparables aux souris normales. Ces effets bénéfiques sur les plaques amyloïdes et la plasticité synaptique s’accompagnent, autour des plaques, de l’activation des astrocytes, ces cellules dont le rôle protecteur a été identifié dans la maladie d’Alzheimer.
« Ce travail fait la preuve de l’intérêt des immunothérapies pour le traitement de la maladie d’Alzheimer, et notamment de l’intérêt de l’interleukine-2, estiment les auteurs. Ce traitement s’attaque aux conséquences de la maladie, la perte des synapses et les symptômes cognitifs qui l’accompagnent. Son potentiel thérapeutique devra maintenant être évalué chez l’homme », concluent-ils.
Ces résultats viennent confirmer ceux obtenus en février dernier par une autre équipe de chercheurs français dirigée par Guillaume Dorothée et réaffirment l’excellence des recherches menées à l’Inserm dans ce domaine.
Légende de la photo : Béatrice Clémenceau de l’équipe 8 « Sélection et modifications fonctionnelles des lymphocytes T pour l’immunothérapie. Etude des lymphocytes T capables d’ADCC ». Conservation de cellules de patients dans l’azote liquide au laboratoire de l’unité 892 « Centre de Recherche en Cancérologie Nantes – Angers ».