Crédits: AdobeStock
Si l’on savait que le virus Zika se transmettait par voie sexuelle et que le virus persistait dans le sperme plusieurs mois après l’infection, l’origine de cette persistance était inconnue, de même que les raisons de la diminution du nombre de spermatozoïdes chez les hommes infectés. Une équipe de chercheurs de l’Inserm, de l’Université de Rennes 1 et de l’Ecole des Hautes Etudes en Santé Publique réunie au sein de l’Institut de recherche en santé, environnement et travail (IRSET, Unité 1085) et dirigée par Nathalie Dejucq-Rainsford a montré que le virus infecte plusieurs types de cellules testiculaires, dont les cellules germinales, à l’origine des spermatozoïdes, ce qui pourrait altérer le processus de fabrication des cellules sexuelles. Par ailleurs, la faible défense immunitaire du testicule contre le virus Zika pourrait nuire à l’élimination du virus dans cet organe et ainsi contribuer à sa persistance dans le sperme. Ces travaux sont publiés dans la revue Journal of Clinical Investigation.
Le virus Zika, transmis par les moustiques, induit des malformations congénitales et peut être également transmis par voie sexuelle de l’homme à la femme. Le virus peut persister dans le sperme pendant plusieurs mois, et être transmis plus de 40 jours après la disparition des symptômes, ce qui suggère que l’appareil reproducteur masculin est infecté. Des modèles animaux suggèrent que la transmission sexuelle pourrait faciliter l’infection du fœtus chez la femme enceinte. Une diminution du nombre de spermatozoïdes et une augmentation des spermatozoïdes anormaux a également été rapportée dans le sperme d’hommes infectés. Cependant l’organe responsable de la persistance du virus dans le sperme restait inconnu, ainsi que l’origine des modifications du sperme.
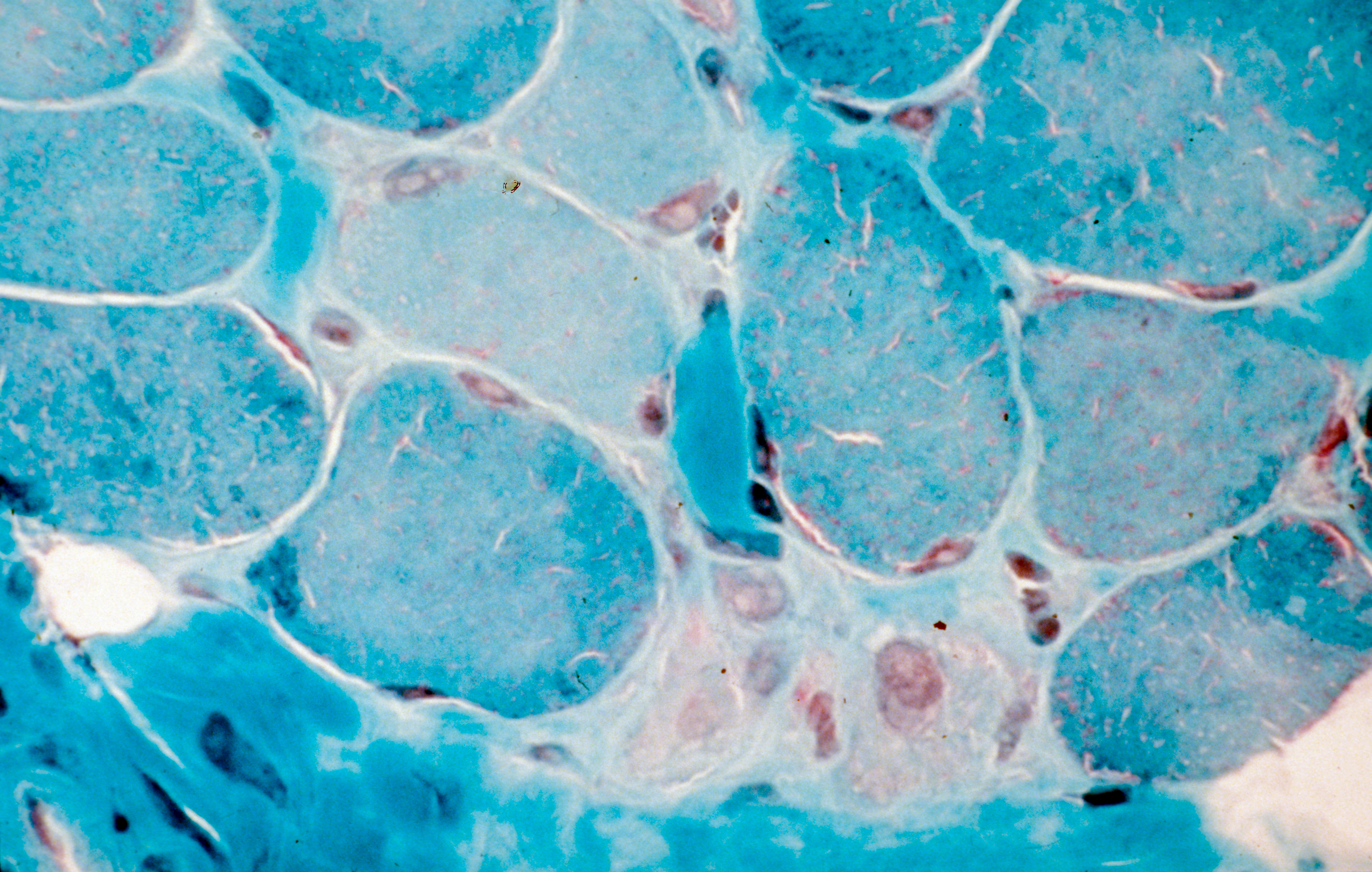
Grâce à un modèle original de culture de testicule humain, l’équipe de Nathalie Dejucq-Rainsford, chercheuse Inserm au sein de l’Unité 1085″ Institut de recherche, santé, environnement et travail » (Inserm/Université de Rennes 1/Ecole des Hautes Etudes en Santé Publique) avec l’appui d’équipes de la métropole, des Antilles et du Brésil, a montré que le virus Zika infecte plusieurs catégories de cellules testiculaires, dont les cellules germinales, à l’origine des spermatozoïdes.
Pour cela des fragments de testicules d’hommes non infectés ont été exposés au virus puis maintenus en culture pendant 9 jours pour suivre l’évolution de l’infection. Ces résultats ont été confirmés chez des patients infectés par le virus Zika avec la mise en évidence de cellules germinales testiculaires et de spermatozoïdes infectés dans le sperme.En poussant plus loin les analyses, les chercheurs suggèrent que le testicule pourrait constituer un réservoir pour le virus Zika, expliquant ainsi que l’on retrouve du virus dans le sperme longtemps après qu’il ait disparu du reste de l’organisme. En effet cet organe se défend faiblement contre l’infection car il ne produit pas les protéines essentielles à la réponse antivirale (interférons) et qu’il ne produit qu’en très petite quantité les molécules chargées de signaler la présence de pathogènes au système immunitaire (cytokines pro-inflammatoires). De plus, contrairement à d’autres organes, les cellules testiculaires infectées ne meurent pas et perdurent dans le testicule.
L’ensemble de ces éléments pourraient permettre la production de virus au sein du testicule pendant de longues périodes, sans qu’il ne soit éliminé par le système immunitaire.
Enfin, l’infection des cellules germinales elles-mêmes et d’autres cellules testiculaires impliquées dans le processus de fabrication des spermatozoïdes (cellules de Sertoli, cellules de Leydig) et dans leur expulsion hors du testicule (cellules contractiles péritubulaires) pourrait affecter la production de sperme. Une hypothèse soutenue par l’observation des modifications du sperme constatées chez des hommes infectés jusqu’à deux mois après contact avec le virus Zika.
Cette étude fournit des informations essentielles sur la manière dont le virus Zika peut persister dans le sperme et en modifier les paramètres, ainsi qu’un outil précieux pour tester l’efficacité d’agents antiviraux sur l’infection du testicule ex vivo.