![]()
©Photo by rawpixel on Unsplash
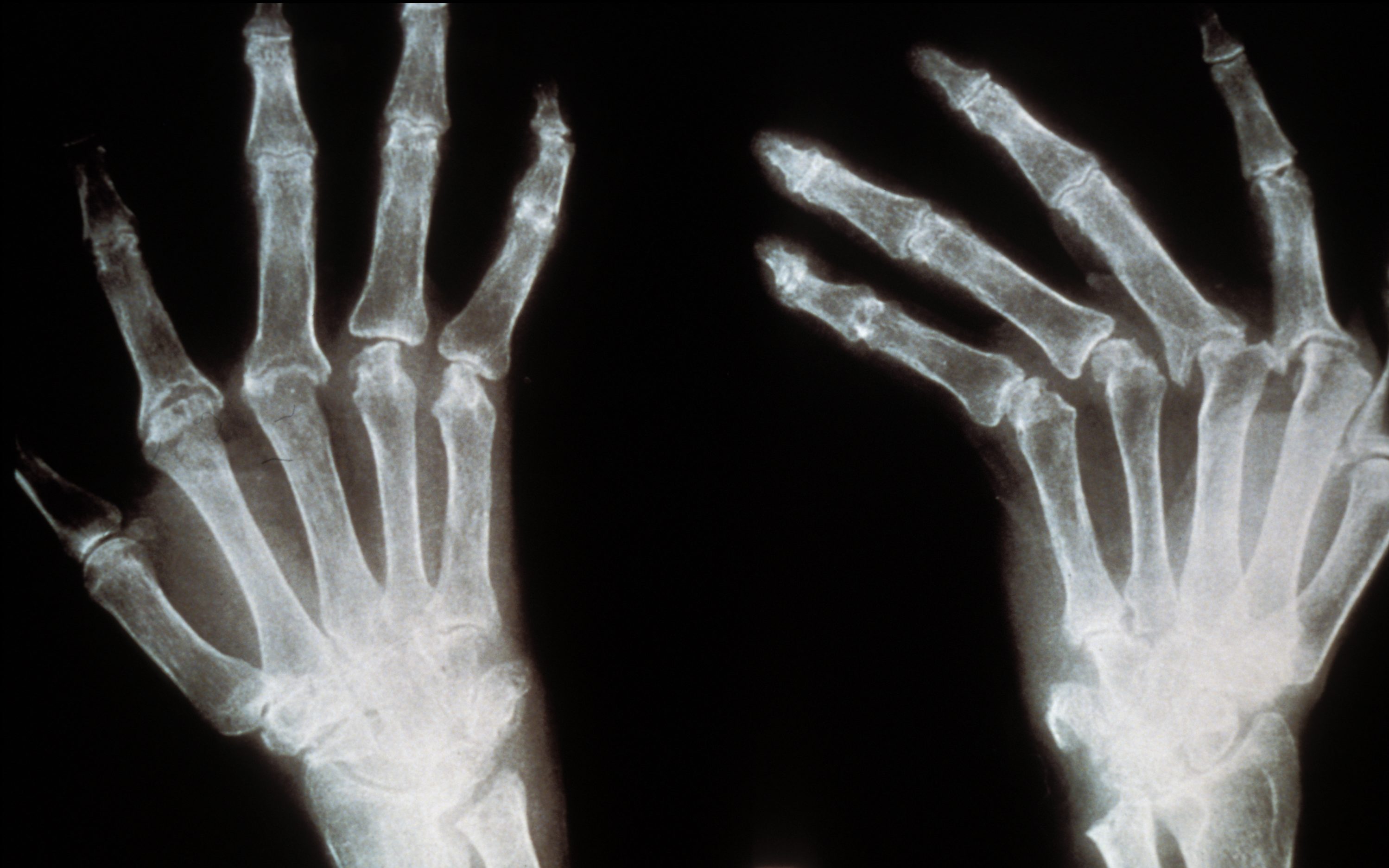
La diminution du volume osseux de la mâchoire chez les personnes édentées est la principale difficulté rencontrée pour la pose d’implants dentaires. Pour y remédier, la greffe osseuse est aujourd’hui la solution la plus fréquente. Celle-ci présente cependant plusieurs inconvénients dont une dégradation dans le temps de l’os greffé. Entre 2010 et 2015, Pierre Layrolle, chercheur Inserm, en collaboration avec des équipes norvégiennes, et allemandes, au sein du projet européen REBORNE, a testé une technique innovante d’augmentation osseuse chez 11 patients édentés, en combinant un biomatériau avec des cellules souches. Les résultats, parus dans la revue Stem Cell Research & Therapy montrent l’apparition d’os vivant sur la zone traitée en quantité suffisante pour permettre la pose d’implants ainsi qu’un maintien durable de cet os après la pose de prothèses dentaires.
Chez les patients édentés, on peut observer – faute de stimulation mécanique par la mastication – une fonte osseuse au niveau de l’os alvéolaire (entourant et maintenant la dent) qui représente un tiers des contre-indications pour la pose d’implants dentaires. En effet, cette intervention nécessite un volume osseux suffisant afin de ne pas risquer de toucher le nerf facial, ce qui aurait pour conséquence de créer une paralysie du visage. Or, en l’absence d’un volume osseux suffisant sur le maxillaire pour soutenir les tissus mous de la gencive, même le dentier, s’avère peu adapté.
Si l’augmentation osseuse utilisant des biomatériaux est utilisée avec succès pour combler une alvéole dentaire, aujourd’hui la technique la plus fréquente pour remédier à la perte ancienne de plusieurs dents est celle de la greffe osseuse avec un prélèvement d’os effectué sur la mandibule ou le crâne du patient. Outre les risques post-opératoires associés à la création de deux sites chirurgicaux, d’une quantité limitée de matériau osseux disponible chez un même patient et de douleurs post-opératoire, cette technique s’avère peu durable dans le temps. En effet, l’os transplanté a tendance à se résorber très vite ; faute de vascularisation et de continuité avec l’os sous-jacent d’origine, il est dégradé par les cellules immunitaires qui le reconnaissent comme un corps étranger.
C’est sur une solution durable d’augmentation osseuse alvéolaire qu’a travaillé de 2010 à 2015 Pierre Layrolle, chercheur Inserm responsable de l’équipe « Inflammation et communications cellulaires dans les pathologies osseuses » (Unité 1238, Inserm/Université de Nantes) en collaboration avec des équipes norvégiennes et allemandes au sein du projet Reborne. Cet essai clinique européen, porte sur le suivi de 11 patients édentés depuis plusieurs années et traités avec une technique innovante d’augmentation osseuse mandibulaire basée sur le principe de la « thérapie cellulaire ».
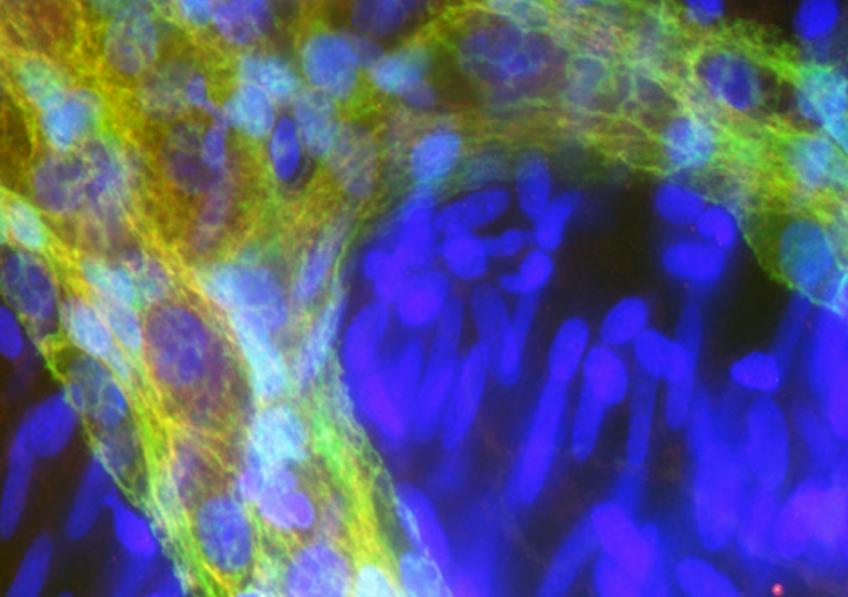
Pour remplacer les lamelles d’os (contenant les cellules du patient et des facteurs de croissance) utilisées classiquement en augmentation osseuse, l’équipe de recherche a utilisé un biomatériau, le phosphate de calcium, auquel elle a adjoint des cellules souches prélevées dans la moelle osseuse de la hanche du patient et amplifiées en culture.
En effet, si le phosphate de calcium n’est pas capable de régénérer de l’os, il permet aux cellules souches – qui elles ont cette fonction – de s’y fixer. Ce biomatériau est de plus très résistant à l’action de dégradation des cellules immunitaires. Le mélange ainsi obtenu a été appliqué sur la partie édentée de la mandibule.Durant 5 mois, les chercheurs ont contrôlé la bonne formation osseuse autour de la greffe, puis ils ont produit un modèle 3D de la partie augmentée pour choisir le type d’implant adapté à chaque patient. Le prélèvement effectué au moment de la pose des implants a révélé que chez les 11 patients non seulement le tissu formé était bien de l’os en quantité suffisante pour justifier la pose d’implants dentaires, mais qu’il était de plus vascularisé contrairement aux greffes osseuses traditionnelles. Deux ans après la pose des implants et des prothèses dentaires, ceux-ci sont fonctionnels chez les 11 patients.
Suite à ces résultats positifs, l’équipe de recherche lance en 2018 le projet européen MAXIBONE, toujours coordonné par Pierre Layrolle. Portant sur 150 patients, cet essai clinique a pour objectif de comparer à plus large échelle les résultats de l’augmentation osseuse maxillaire par thérapie cellulaire avec ceux de la greffe osseuse classique en évaluant la quantité d’os formé entre ces deux types de transplants et leur coût spécifique. Ce projet examinera également la possibilité de remplacer les cellules souches du patient (autologues) par des cellules souches d’un donneur dans la thérapie cellulaire. Cela pourrait permettre de pallier non seulement les difficultés techniques liées au coût et à la complexité du prélèvement et de la conservation des cellules autologues, mais également de compenser l’inégalité des individus à générer plus ou moins efficacement de l’os.
Le projet FP7 Reborne, essai clinique de phase 2, a fait l’objet d’un financement européen de 2010 à 2015.
Le projet H2020 Maxibone, essai clinique de phase 3, fait l’objet de deux financements européens et commencera début 2019.
Pierre Layrolle sera présent au festival international de science-fiction nantais Les Utopiales du 31 octobre au 5 novembre 2018 pour des démonstrations de bioimpression 3D. Il animera la table ronde « En chair étrangère : accepter un corps étranger » le mercredi 31 octobre à 14h