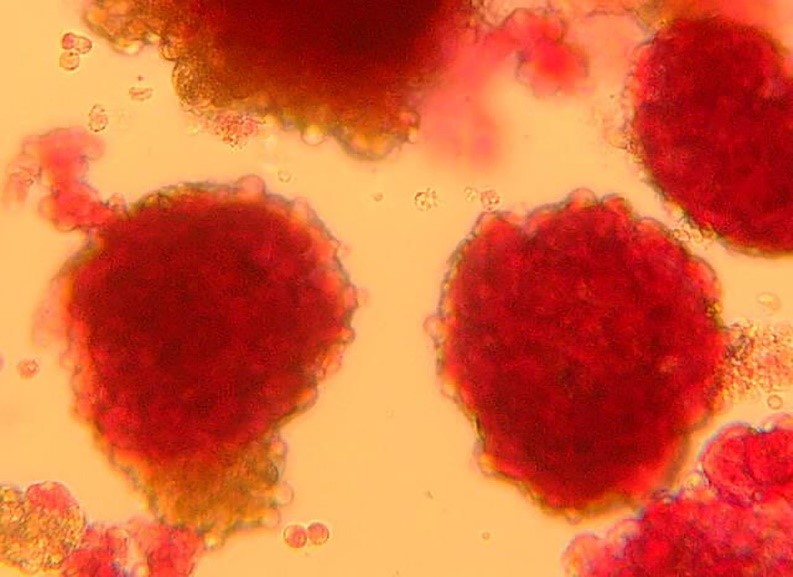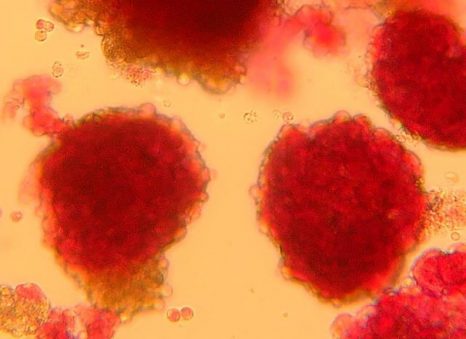
Îlots pancréatiques observés au microscope ©François Pattou/Université de Lille
De la découverte de l’insuline en 1921 jusqu’aux premières greffes de pancréas à la fin des années 60, l’histoire récente de la recherche sur le diabète de type 1 a été jalonnée de succès. Ces avancées scientifiques et médicales ont transformé le pronostic et la qualité de vie des malades.
En France et à l’étranger, les chercheurs continuent d’œuvrer pour améliorer la prise en charge des patients. À l’Inserm, onze équipes réparties dans neuf unités travaillent sur le sujet. Leurs activités portent principalement sur la caractérisation des cellules du pancréas et tentent de parvenir à une meilleure compréhension de la maladie (facteurs de risque, susceptibilité génétique, mécanismes physiopathologiques) et de ses complications.
L’une de ces équipes explore à Lille la transplantation d’îlots, technique prometteuse qui fait l’objet d’une nouvelle publication dans la revue Diabetes Care[1] et d’une mise au point dans The Lancet[2]. D’autres pistes très intéressantes sont aujourd’hui également à l’étude, notamment l’immunothérapie ou le développement de pancréas artificiels.
I. La recherche sur le diabète de type 1 à l’Inserm
Les équipes Inserm sont impliquées dans de nombreux projets collaboratifs pour faire avancer les traitements sur le diabète de type 1. Quelques-uns ont d’ores et déjà donné des résultats prometteurs.
- Le projet EXALT (2014-2019)[3], auquel a participé l’équipe Inserm de Christian Boitard à l’Institut Cochin, visait à évaluer les effets d’une immunothérapie innovante sur des patients atteints de diabète de type 1. Fondée sur l’administration d’un peptide, l’objectif de cette immunothérapie était de modifier la réaction auto-immune dirigée spécifiquement contre les cellules bêta du pancréas. La première partie du projet a montré dans des modèles expérimentaux qu’il y a bien un effet sur la réaction auto-immune du diabète. Les résultats de l’étude clinique de phase 1b sont en cours d’analyse.
- Le projet européen Hypo-RESOLVE,[4] mené sur la période 2018-2022 par Éric Renard à Montpellier (Inserm 1191/UMR 5203), vise à consolider les connaissances scientifiques au sujet de l’hypoglycémie. L’idée est de créer une base de données cliniques pérenne, de mener des études pour mieux comprendre les mécanismes sous-jacents de l’hypoglycémie et de réaliser une série d’analyses statistiques pour en définir les facteurs de prédiction et les conséquences. Par ailleurs, les chercheurs souhaitent aussi calculer le coût financier de l’hypoglycémie dans les pays européens.
- « Pancréas artificiel » : Éric Renard et ses collègues ont mené des travaux en collaboration avec l’Université de Virginie (Charlottesville, VA, USA) pour créer un pancréas artificiel. Le système algorithmique développé a été intégré dans le dispositif Tandem Control-IQ, en vue de commercialisation (voir la photo ci-dessous). Testé actuellement en France chez 120 enfants atteints de diabète de type 1 dans le cadre d’un programme hospitalier de recherche clinique national, les données de l’analyse intermédiaire indiquent un maintien à un taux normal de glycémie 71% du temps sur 24h, avec une réduction significative du temps passé en hypo- et en hyperglycémie. Si le nom peut porter à confusion, il faut savoir que le pancréas artificiel n’est pas un faux organe qui serait greffé au patient. Il s’agit plutôt d’une technologie externe, constitué de trois éléments clés : un capteur, une pompe et un algorithme. Le capteur sous-cutané mesure la glycémie du patient en continu. La pompe perfuse l’insuline par l’intermédiaire d’une fine tubulure positionnée sous la peau. L’enjeu du pancréas artificiel réside aujourd’hui dans la troisième partie du système : l’algorithme capable de faire le lien entre le capteur et la pompe de façon automatique.
- L’équipe Inserm de Raphaël Scharfmann à l’Institut Cochin a apporté au cours des dix dernières années de nouveaux modèles cellulaires du diabète de type 1, sous forme de lignées de cellules bêta humaines. Elle cherche aujourd’hui à développer des thérapies innovantes fondées sur l’usage des cellules souches.
II. Alternative à l’insulinothérapie
a) Îlots producteurs d’insuline
Dans ce contexte d’innovations permanentes, l’allogreffe d’îlots de Langerhans, ces cellules spécialisées du pancréas qui produisent l’insuline, s’est aussi imposée comme une piste thérapeutique particulièrement séduisante. Depuis une vingtaine d’années, François Pattou, Marie-Christine Vantyghem et Julie Kerr-Conte au sein de l’unité Inserm 1190 « Recherche translationnelle sur le diabète » et leurs collègues des services de chirurgie et d’endocrino-diabétologie du CHU de Lille ont développé cette approche et greffé plus de cinquante personnes.
Au-delà du bénéfice incontestable pour les patients, leurs travaux illustrent parfaitement l’apport de la recherche translationnelle et des échanges entre laboratoire et services hospitaliers pour faire progresser les connaissances et les traitements de la maladie.
En France, 3,9 millions de personnes sont diabétiques. Parmi elles, environ 5 % sont atteintes d’un diabète de type 1. Cette forme de la maladie est due au déficit d’une hormone appelée insuline, qui entraîne une élévation prolongée de la concentration de glucose dans le sang (l’hyperglycémie).[5] Le diabète de type 1 est une maladie auto-immune, puisqu’elle est causée par un dysfonctionnement des cellules immunitaires, qui identifient les îlots de Langerhans du pancréas comme des cellules étrangères à l’organisme, et les éliminent. Ces îlots ne peuvent donc plus assurer leur fonction normale de production de l’insuline.
b) Principe de la greffe
À l’heure actuelle, le traitement de référence du diabète de type 1 repose sur l’administration d’insuline, soit en injections sous-cutanées plusieurs fois par jour, soit par pompe. Les patients ont recours à des analogues d’insuline humaine qui permettent de rétablir et maintenir les taux de glycémie à un niveau normal.
Néanmoins, chez certains patients, le diabète n’est pas parfaitement régulé par ce traitement, malgré un suivi strict des conseils alimentaires et thérapeutiques. Des complications sévères peuvent alors survenir. Un contrôle glycémique insuffisant peut en effet être délétère pour les organes, affectant en premier lieu le cœur et les vaisseaux, mais aussi les petites artères qui alimentent les reins, les nerfs des membres inférieurs et la rétine.
À côté des approches technologiques (pompe à insuline, capteurs de glucose et bientôt pompe en boucle fermée), l’approche biologique par la greffe d’îlots a constitué une étape essentielle pour la recherche sur le diabète. En permettant de restaurer une sécrétion d’insuline quasi physiologique, la greffe de cellules insulino-sécrétrices transforme la vie des patients, qui se trouvaient jusqu’ici en impasse thérapeutique.
Le principe de la greffe d’îlots ou thérapie cellulaire du diabète est de remplacer les cellules détruites du pancréas afin de rétablir une production régulée d’insuline. Se faisant, elle permet de normaliser le contrôle glycémique des malades, voire d’interrompre l’insulinothérapie. « La greffe d’îlots est proposée à deux profils de patients : d’une part ceux qui ont un diabète de type 1 très instable, souvent ancien, avec notamment la survenue d’hypoglycémies sévères et/ou non ressenties, d’autre part les patients greffés d’un rein, qui prennent déjà des médicament immunosuppresseurs qu’il suffit alors d’ajuster », souligne Marie-Christine Vantyghem.
II. Deux décennies de greffes
a) Les débuts de la greffe d’îlots
Pendant longtemps, pour les patients diabétiques de type 1 dont les complications rénales justifiaient une greffe de rein, la greffe simultanée de pancréas entier a représenté l’alternative thérapeutique la plus efficace à l’insulinothérapie. Cette tendance pourrait néanmoins s’inverser au cours des prochaines années, car cette procédure comporte des risques non négligeables. Il s’agit en effet d’un organe fragile et difficile à prélever chez les donneurs.
L’injection des îlots, c’est-à-dire seulement des cellules utiles, sécrétrices d’insuline, constitue une intervention moins lourde et tout aussi efficace. « La greffe de pancréas est une intervention efficace mais au prix d’un risque élevé de complications parfois sévères. Tant que la greffe d’îlots ne fonctionnait pas bien, et qu’elle ne rétablissait pas un contrôle glycémique adapté, la greffe du pancréas permettait de meilleurs résultats. Mais la greffe d’îlots, moins risquée, a beaucoup progressé et peut être proposée aujourd’hui chez des patients qui ne supporteraient pas une greffe de pancréas », précise François Pattou.
Les premiers essais expérimentaux puis cliniques de cette technique remontent à la fin des années 60. Toutefois, c’est l’année 2000 qui est considérée comme un tournant majeur dans l’histoire de l’allogreffe d’îlots. Cette année-là, des chercheurs canadiens publient les résultats d’un essai clinique dans le New England Journal of Medicine[6]. Grâce à une greffe d’îlots pancréatiques, sept patients atteints d’un diabète de type 1 sont devenus entièrement insulino-indépendants. Ils n’avaient plus besoin d’avoir recours aux injections d’insuline depuis un an.
« Après 2000, les travaux autour de cette procédure ont explosé, et d’autres succès ont été rapportés dans le monde, notamment par notre groupe. Le problème, c’est que très peu d’études se sont ensuite intéressées aux patients sur la durée, et nous sommes les premiers à présenter les résultats d’une étude à 10 ans », soulignent François Pattou et Marie-Christine Vantyghem.
b) Suivi sur 10 ans
La nouvelle étude publiée dans Diabetes Care de François Pattou, Marie-Christine Vantyghem et leurs équipes, retrace en effet la trajectoire de 28 patients ayant bénéficié d’une greffe d’îlots entre 2003 et 2012. Souffrant d’insuffisance rénale, la moitié d’entre eux avaient en outre déjà été greffés du rein.
Avant ces travaux, plusieurs groupes avaient déjà publié des résultats sur l’évolution de patients greffés avec des îlots pancréatiques, mais aucun n’était allé au-delà d’un suivi à cinq ans. Tous soulignaient des bénéfices cliniques pour les patients et une amélioration de leur qualité de vie. Toutefois, en l’absence d’un suivi rigoureux à plus long terme, des questions demeuraient en suspens : les bénéfices de la greffe d’îlots déclinaient-ils au-delà de cinq ans ? Qu’en était-il des complications associées à la prise d’immunosuppresseurs ?
Le protocole opératoire pour réaliser la greffe d’îlots pancréatiques a été mis en place au cours des deux dernières décennies par l’équipe lilloise, en mettant l’accent non seulement sur la qualité, mais aussi sur la quantité des îlots greffés. « Nous avons choisi de greffer initialement un nombre important d’îlots. S’ils proviennent d’un pancréas particulièrement robuste, et contenant beaucoup d’îlots, une seule greffe peut suffire. Cette situation est cependant l’exception et une ou deux greffes supplémentaires sont le plus souvent nécessaires. La particularité de notre programme est de planifier les nouvelles greffes rapidement, sans les conditionner aux résultats de la première, pour donner toutes les chances aux patients de retrouver une production d’insuline normale », explique François Pattou.
Greffe d’îlots : quelques mots sur la procédureLes îlots sont aujourd’hui isolés dans quelques laboratoires spécialisés, à Lille par l’équipe de Julie Kerr-Conte, mais aussi à Genève, Paris, Montpellier et Strasbourg à partir de pancréas prélevés chez des donneurs en état de mort cérébrale.
La préparation d’îlots est ensuite injectée dans le foie par une courte incision abdominale ou par voie percutanée afin de perfuser les îlots collectés dans la veine porte du foie. La thrombose constitue le risque principal de cette procédure, et les patients doivent donc recevoir des anticoagulants.

Îlots pancréatiques observés au microscope – François Pattou/Université de Lille
c) Des résultats prometteurs
Dans le cadre de leur étude, les patients ont été vus à l’hôpital au moins une fois par an pendant dix ans pour vérifier l’état de la greffe. La plupart ont été suivis de façon trimestrielle. À chaque visite, la situation clinique, l’équilibre glycémique, les besoins en insuline exogène (apportée de l’extérieur) et les complications du traitement et du diabète étaient évaluées.
L’équipe de recherche avait choisi d’étudier comme critère principal l’insulino-indépendance avec un équilibre glycémique normal. Les médecins souhaitaient en effet déterminer la proportion de leurs patients capable de maintenir un bon contrôle glycémique, sans apport exogène d’insuline. L’étude souligne que c’est le cas au bout de cinq ans pour la moitié des 28 patients, et à dix ans, encore pour près d’un tiers (28 %). Ces résultats sont similaires à ceux obtenus avec la greffe de pancréas entier.
Les chercheurs ont également montré que 80 % des patients avaient une greffe toujours fonctionnelle au bout de cinq ans, sans évènement majeur d’hypoglycémie. Après dix ans, c’était toujours le cas pour les deux tiers d’entre eux. Enfin, la fonction rénale ne s’était pas détériorée de façon significative, malgré la possible toxicité rénale des immunosuppresseurs, celle-ci étant probablement compensée d’une part par un ajustement étroit des doses, d’autre part par l’excellent contrôle glycémique obtenu chez la plupart des patients.
Ces résultats montrent que la greffe permet d’améliorer considérablement l’équilibre glycémique des patients diabétiques de type 1 instables, de les mettre à l’abri du risque potentiellement mortel des hypoglycémies sévères et non ressenties, d’éviter les complications graves de la maladie et d’augmenter significativement leur qualité de vie.
Pour comprendre pourquoi la greffe est plus efficace à long terme chez certains patients que chez d’autres, plusieurs pistes se dessinent. « Il semblerait qu’il y ait un signal en faveur des femmes, et certains éléments expérimentaux montrent que la présence d’œstrogènes serait favorable à la survie des îlots. Les patients qui ont les meilleurs résultats à long terme sont surtout ceux qui avaient retrouvé un bon contrôle glycémique juste après la greffe. Si nous voulons l’optimiser, il faut miser sur la qualité et la quantité des îlots que nous greffons au départ », indiquent François Pattou et Marie-Christine Vantyghem.
Les démarches pour le remboursement de la greffe d’îlots sont actuellement engagées auprès de la Haute Autorité de santé. La réponse est attendue pour 2020.
III. Quelles perspectives d’avenir ?
Différents problèmes demeurent, notamment le possible rejet immunologique des cellules greffées, et le nombre limité de cellules insulino-sécrétrices humaines disponibles pour la greffe dans le contexte actuel de pénurie de donneurs.
En effet, pour éviter le rejet de leur greffe, les patients doivent se soumettre à un traitement immunosuppresseur qui comporte un certain nombre d’effets indésirables. Plusieurs équipes s’efforcent aujourd’hui de trouver de nouvelles solutions pour éviter ce rejet de greffon. Par ailleurs, afin de développer des alternatives aux donneurs humains, de nombreuses équipes dans le monde mènent actuellement des études visant à produire des îlots à partir de cellules souches pluripotentes, et de les greffer avec succès[7].
Ces deux problématiques pourraient être résolues par une approche commune pour diffuser plus largement la thérapie cellulaire du diabète : « Le Graal serait de produire au laboratoire des îlots à partir de cellules souches puis de les greffer au sein d’une capsule de biomatériaux les protégeant du système immunitaire », souligne François Pattou.
De plus, de nombreux travaux sont en cours pour développer des pancréas artificiels totalement autonomes. À l’heure actuelle, le contrôle glycémique obtenu avec ces dispositifs externes reste inférieur à celui obtenu par la greffe et la restauration « biologique » de la sécrétion d’insuline. « Ces approches s’avèrent néanmoins complémentaires et seront proposées en fonction du profil de chaque patient », précise Marie-Christine Vantyghem
La publication des résultats de la greffe d’îlots à 10 ans est une nouvelle étape importante dans le traitement du diabète de type 1. Ces résultats démontrent en effet que la thérapie cellulaire peut fonctionner sur le long germe si la masse d’îlots transplantée est suffisante. Ces travaux ouvrent des perspectives très intéressantes pour toutes les équipes qui travaillent sur de nouvelles sources de cellules insulino-sécrétrices, produites notamment à partir de cellules souches et qui permettront de pallier le manque de donneurs.
IV. Témoignages de patients
Michèle, 61 ans, greffée depuis 14 ans

©Alain Vanderhaegen, Direction Communication du CHU de Lille
« Votre fille ne vivra pas au-delà de l’année 2000. Elle ne se mariera jamais et n’aura pas d’enfants ». C’est en ces termes qu’un médecin peu empathique déclare à la mère de Michèle que son enfant souffre de diabète de type 1. À ce moment, la fillette ne comprend pas bien ce qui est en train de se passer. Nous sommes dans les années 1970, et l’an 2000 lui paraît bien loin. Elle ne se sent pas malade. Certes, ces derniers temps elle avait beaucoup maigri, mais elle n’a souffert d’aucun malaise.
Tout à coup, tout change. Son hospitalisation en dortoir, seule petite fille au milieu de personnes âgées victimes d’importantes complications liées au diabète, notamment des amputations, est vécue comme un véritable traumatisme. « Psychologiquement, cela a été très dur. Ensuite, j’ai eu une vie de mensonges, à éviter les questions des autres », explique-t-elle.
La prise des traitements est difficile. Il faut affuter les aiguilles, faire bouillir les seringues et s’injecter l’insuline, avec en permanence le sentiment de honte, la volonté de se cacher. Michèle avance, elle tient le coup. Elle rencontre son mari Jacques, avec qui elle a un fils. Tous deux la soutiennent. Tout petit, son garçon a appris à réagir face aux hypoglycémies de sa mère, à aller chercher le sucre dans les placards quand celle-ci en manifeste le besoin.
Mais les crises d’hypoglycémie sévères se font plus fréquentes. Certains jours, ce sont cinq à six crises qui se succèdent, laissant Michèle et ses proches épuisés. Son diabétologue, qui avait rencontré les équipes lilloises lors d’une conférence, décide alors de l’orienter vers la greffe d’îlots. Il lui faudra un an pour qu’elle se décide à sauter le pas, en 2006. Trois greffes s’enchainent alors très rapidement. Tout de suite après la troisième, Michèle peut arrêter les injections d’insuline. « Que les cellules proviennent de donneurs décédés me bloquait. J’avais aussi peur que la greffe me transforme. De fait, cela a changé ma vie mais je suis restée la même, à la différence qu’il y a toujours avec moi ces trois personnes. Il y a cette ombre-là qui est permanente. C’est pourquoi, si la recherche pouvait avancer sur la greffe à partir de cellules souches, cela serait un grand pas en avant », souligne-t-elle.
Cela fait maintenant 14 ans que Michèle a arrêté l’insuline, qu’elle prend les médicaments immunosuppresseurs tous les jours, sans effets indésirables majeurs. Pour ses proches comme pour elle, c’est une libération. « Je suis redevenue une femme libre, avec mon mari nous pouvons refaire des choses de manière indépendante. Parfois je m’inquiète du vieillissement de la greffe, revenir en arrière serait inconcevable », dit-elle.
Carole, 60 ans, greffée depuis 4 ans

©Alain Vanderhaegen
À 14 ans, Carole rentre en seconde, à l’internat. L’expérience lui déplait, d’autant qu’elle ne cesse de s’évanouir. Cependant, lorsque ses parents la changent de lycée, les choses semblent aller mieux. Elle se sent bien, ne pense plus à ses malaises. Jusqu’à une visite médicale qui révèle du sucre dans ses urines, suivie d’une prise de sang qui confirme le diagnostic de diabète de type 1.
À l’école, après un mois d’hospitalisation, tout le monde fait très attention à elle. « Je pouvais dire n’importe quoi en classe, parce qu’on se disait : « la pauvre, elle n’y est pour rien, elle est diabétique« . J’en ai bien profité, je me suis amusée », explique-t-elle.
Elle supporte bien les traitements, mange presque normalement, passe son bac et devient institutrice. Sur son lieu de travail, elle a toujours des bouteilles de jus d’orange à portée de main en cas de crise.
Mais progressivement, les hypoglycémies se font plus sévères, elles sont non ressenties. Elles empiètent sur son quotidien et détériorent sa qualité de vie. « À la naissance de ma fille, les médecins n’avaient pas tenu compte de mon diabète. J’ai fait un œdème pulmonaire, j’ai été hospitalisée ailleurs. Je n’ai pas vu mon bébé pendant 15 jours, et j’ai fait la grève de la faim pour qu’on me laisse la voir. Quand je suis sortie de l’hôpital, un matin j’ai fait une hypoglycémie. Soudain, je ne me souvenais plus que j’avais une fille, je l’avais oubliée. Si j’avais été toute seule, j’aurais été capable de sortir et de la laisser à la maison », raconte-t-elle.
Un jour, un ami lui parle d’une émission radio, dans laquelle il a entendu parler de la greffe d’îlots qui est proposée à Lille. Carole en discute avec son diabétologue qui promet de se renseigner. Finalement, c’est elle qui trouvera les coordonnées de l’équipe.
Greffée en 2015 et 2016 à trois reprises, Carole est bien décidée à profiter à nouveau de sa vie. Dès la deuxième greffe, elle est insulino-indépendante. Cinq ans plus tard, elle vit toujours bien la prise d’immunosuppresseurs, qu’elle n’oublie jamais. Les hypoglycémies ont disparu. Elle peut désormais conduire, refaire du sport, se balader seule sans avoir à partager tout son emploi du temps avec son mari. « Je peux même remanger des gâteaux quand des proches en font. Mais j’ai tellement été habituée à ne pas manger de sucre, que maintenant en fait, je n’aime pas ça. La greffe a changé ma vie alors que j’étais dans une situation où je ne faisais plus rien par moi-même. Ces îlots, se sont mes amis, je leur ai donné un nom et je leur fête leur anniversaire », sourit-elle.
Béatrice, 54 ans, greffée depuis 1 an

©Alain Vanderhaegen
L’adolescence de Béatrice a été fortement perturbée par l’annonce de son diabète. Originaire d’un milieu rural près de Rennes, aucune des personnes de son entourage n’avait entendu parler de la maladie avant son diagnostic à l’âge de 11 ans. Les débuts sont difficiles : à l’école personne ne fait l’effort de comprendre la situation qu’elle traverse. Elle est obligée de manger dans les cuisines de la cantine, et se retrouve souvent seule dans la cour de récréation. Les injections d’insuline améliorent un peu la situation, même si des effets indésirables sont à noter, notamment la prise de poids à chaque augmentation des doses. Par ailleurs, Béatrice souffre de la discrimination dont elle est victime, et qu’elle retrouvera plus tard dans le milieu professionnel.
Au fil des années, de nouvelles technologies voient le jour pour aider les patients comme Béatrice à mieux contrôler leur glycémie. C’est le cas des pompes avec arrêt automatique d’insuline, et des capteurs qui mesurent en continu la glycémie. Néanmoins, il y a aussi de désavantages : en cas d’hypoglycémie, une alarme se déclenche, à toute heure du jour et de la nuit. « C’était très difficile à vivre au quotidien. Quand j’ai enfin été greffée mon mari a fait la remarque que désormais, « nous pouvions enfin dormir« . Notre qualité de vie a été nettement améliorée », souligne-t-elle.
C’est en lisant un article dans le journal de l’Association françaises des diabétiques que Béatrice découvre la greffe d’îlots. Elle est fatiguée, elle vient de perdre son travail. « J’avais l’impression d’être en bout de parcours, il me fallait une solution nouvelle, pour survivre. Pour continuer à vivre tout simplement. En lisant, j’ai tout de suite eu le sentiment que la greffe était pour moi », explique-t-elle.
Il s’écoulera deux ans avant qu’elle ne puisse convaincre sa diabétologue de l’orienter vers des connaisseurs du sujet, et qu’elle ne rencontre enfin l’équipe Inserm-CHU de Lille. Fin 2018, Béatrice bénéficie d’une greffe à trois reprises. Elle est insulino-indépendante très rapidement après. « Je perçois la greffe comme un cadeau énorme. Par respect pour les donneurs, il faut que je continue à me battre. J’ai envie de les faire vivre, je les appelle mes petits anges », explique-t-elle.
Si la prise d’immunosuppresseurs s’accompagne de désagréments, notamment des sensations de fourmillements dans les jambes, Béatrice reconnaît que ceux-ci sont bien moindres que ne l’étaient les complications liées à son diabète de type 1. « Le diabète de type occupait toutes mes pensées, j’avais l’impression de faire ma vie autour de la maladie. Nous verrons comment mon état évolue, et comment la greffe tient dans les prochaines années, mais un an après la procédure, je suis optimiste. Pour la première fois depuis longtemps, j’ai de l’espoir », dit-elle.
LexiqueÎlots de Langerhans Les cellules des îlots de Langerhans (ou îlots pancréatiques) sont des cellules endocrines du pancréas dont la fonction principale est la production de l’insuline. Les îlots de Langerhans sont des micro-organes complexes disséminés dans le pancréas exocrine.
Allogreffe Greffes les plus courantes, qui concernent les cas où le donneur et le receveur sont de la même espèce biologique, mais étrangers l’un à l’autre.
Xénogreffe : Greffe dans laquelle le greffon provient d’une espèce biologique différente, par exemple le porc.
Cellules souches pluripotentes : Cellules capables de se multiplier à l’infini et de se différencier en tous les types de cellules qui composent un organisme adulte.
[1] https://care.diabetesjournals.org/sites/default/files/care_upcoming/DC190401_ADVANCEDCOPY_STAMPED.pdf
[2] “Advances in β-cell replacement therapy for the treatment of type 1 diabetes”.
Vantyghem MC, de Koning EJP, Pattou F, Rickels MR.
Lancet. 2019 Oct 5;394(10205):1274-1285.
[3] https://cordis.europa.eu/project/rcn/110445/reporting/en
[4] https://hypo-resolve.eu/
[5] https://www.inserm.fr/information-en-sante/dossiers-information/diabete-type-1
[6] « Islet Transplantation in Seven Patients with Type 1 Diabetes Mellitus Using a Glucocorticoid-Free Immunosuppressive Regimen », New England Journal of Medicine, Juillet 2000. https://www.nejm.org/doi/full/10.1056/NEJM200007273430401
[7] https://www.ajd-diabete.fr/le-diabete/tout-savoir-sur-le-diabete/le-traitement/