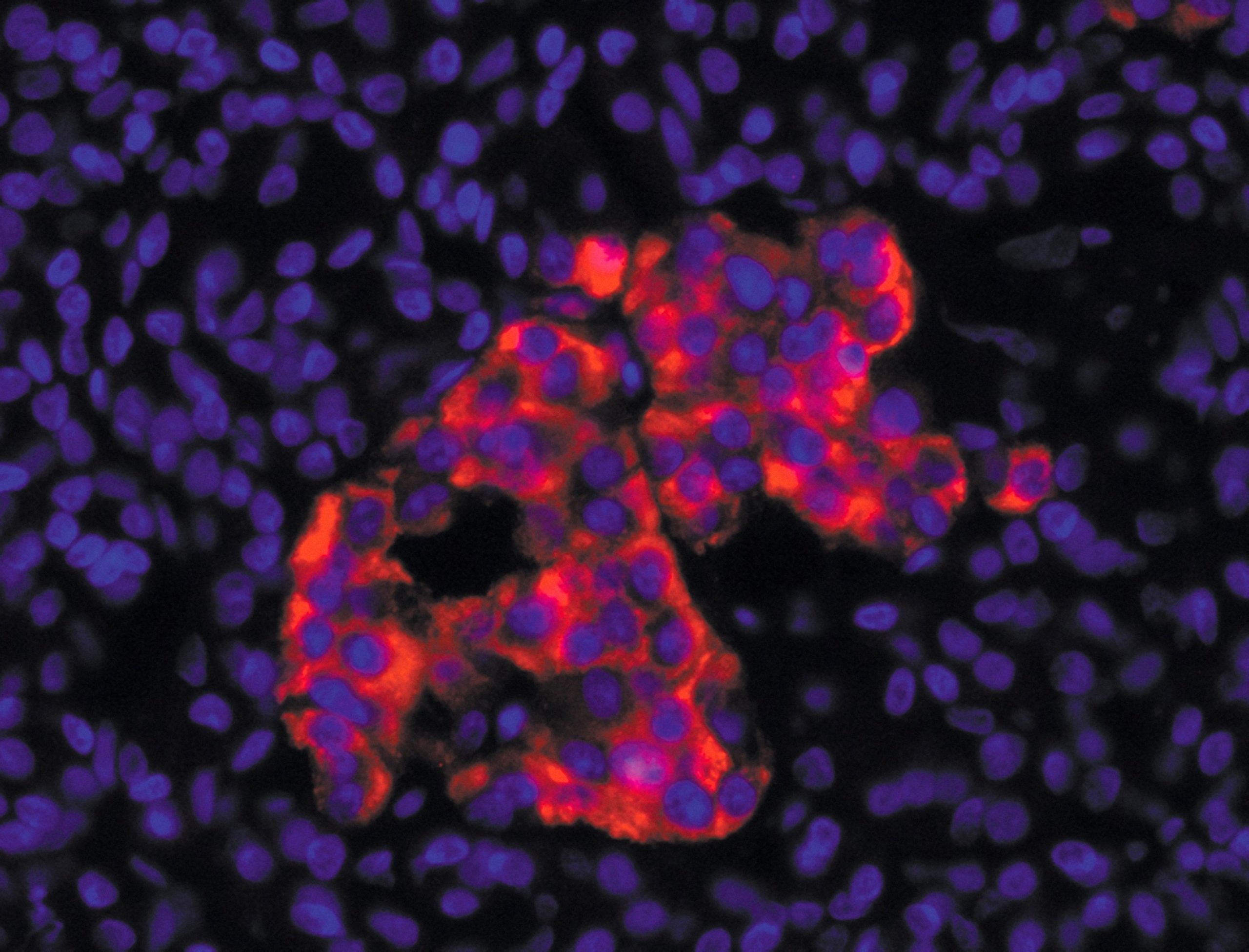
Echantillons sanguins dans la cohorte Constances et tests sérologiques de l’infection au virus SARS-Cov-2. A gauche : des cellules non infectées par le virus SARS-CoV-2, preuve que l’échantillon de sang contenait des anticorps neutralisants capable d’empêcher le virus d’entrer dans les cellules. A droite : de nombreuses cellules ont été détruites, preuve de l’absence d’anticorps neutralisants contre le virus. ©Unité des Virus Émergents (Inserm – Aix Marseille Université – IRD)
Des chercheurs de l’Institut Pasteur, du CNRS, de l’Inserm et d’Université de Paris ont réalisé une étude pilote pour évaluer la fiabilité de plusieurs tests de laboratoire afin de mieux comprendre le profil de réponses en anticorps contre le SARS-CoV-2 et la propagation du virus dans la population. A ce jour, quatre tests de détection d’anticorps anti SARS-CoV-2 ont été développés et évalués ainsi que deux tests de détection d’anticorps neutralisants. Ces tests, dits de laboratoire, sont une première étape pour les études épidémiologiques sur COVID-19. Les résultats de cette étude ont été publiés en ligne sur MedRxiv, le 24 avril 2020, puis dans Science Tanslational Medicine, le 17 août 2020.
Pour endiguer l’épidémie et mieux comprendre la propagation du virus, il est extrêmement important d’évaluer la prévalence des cas asymptomatiques et symptomatiques d’infection par le SARS-CoV-2 et leur profil de réponses en anticorps.
Actuellement, les tests basés sur la PCR sont largement utilisés en France et dans le monde, pour le diagnostic du COVID-19 et pour la détection et la quantification de l’ARN du SARS-CoV-2. Ces tests virologiques sont essentiels pour identifier et surveiller les individus atteints d’infections actives.
Parallèlement, des tests sérologiques sont également mis en œuvre. Ces tests sont de deux types :
- Les tests de détection d’anticorps qui permettent d’évaluer si une personne a développé des anticorps contre des protéines du SARS-CoV-2, et donc, si elle a antérieurement contracté le virus.
- Les tests de neutralisation qui permettent quant à eux de déterminer si une personne possède des anticorps neutralisants et si elle est donc immunisée contre le virus.
Des tests fiables nécessaires
Des tests fiables sont essentiels. Plusieurs équipes de l’Institut Pasteur, du CNRS, de l’Inserm et d’Université de Paris se sont donc mobilisées pour développer différents tests sérologiques et ont donc réalisé une étude pilote pour évaluer la fiabilité de 4 tests de détection en mesurant les niveaux d’anticorps anti-SARS-CoV-2. Parallèlement, deux tests de détection ont été développés et ont permis une comparaison supplémentaire. Les groupes d’échantillons sanguins proviennent de différentes catégories d’individus. Ces groupes ayant servi à l’évaluation de ces tests étaient répartis de la manière suivante :
- des échantillons de 400 individus pré-épidémiques (2017-2019), servant d’échantillons de comparaison afin d’établir la spécificité des tests en s’assurant qu’il n’y a pas ou très peu de « faux positifs » ;
- des échantillons de 51 patients positifs au COVID-19 avec des formes sévères ou critiques, provenant de l’hôpital Bichat (Paris). Cela permet d’établir la sensibilité des tests, et d’étudier les cinétiques d’apparition des anticorps ;
- des échantillons de 209 individus présentant des symptômes légers (fièvre ou toux par exemple) prélevés dans le département de l’Oise les 3 et 4 mars 2020 ;
- des échantillons de 200 donneurs de sang de l’Oise, asymptomatiques et prélevés entre le 20 et le 24 mars 2020.
Résultats de séroprévalence
La séropositivité (présence d’anticorps) a été détectée chez 32% des individus ayant présenté des signes légers compatibles avec COVID-19 dans les 15 jours précédant les prélèvements et chez 3 % des personnes asymptomatiques, ayant donné leur sang.
Délai d’apparition des anticorps
Les chercheurs ont caractérisé les délais d’apparition des anticorps chez les personnes hospitalisées atteintes de COVID-19. Les anticorps apparaissent dès 5-6 jours après les premiers symptômes et ils possèdent une activité neutralisante dès 7-14 jours.
Ce délai est probablement plus long chez les personnes pauci-symptomatiques (avec peu de symptômes) ou asymptomatiques (aucun symptôme), et les titres (concentration) d’anticorps plus faibles.
Description et évaluation des tests
Les équipes de recherche ont conçu quatre tests de laboratoire pour évaluer les niveaux d’anticorps anti-SARS-CoV-2 dans le sérum humain.
Tests ELISA : Les deux tests ELISA sont des tests classiques, utilisant comme antigènes cibles la protéine N entière du SARS-CoV-2 (ELISA N) ou le domaine extracellulaire du spicule du virus (S).
Avantages : ces tests utilisent une technique facilement transposable et qui est utilisée dans des kits commerciaux. Le test ELISA S est un peu plus sensible que l’ELISA N.
Pour ces deux tests, se pose la question de leur utilisation à grande échelle, ou de leur industrialisation. Pour l’instant ce sont des tests maison. Des tests de principe similaire sont déjà commercialisés, et sont en cours d’évaluation par le CNR.
Les performances des tests commerciaux sont évaluées par le CNR en utilisant des sérums qui ont été qualifiés comme négatifs ou positifs en anticorps dirigés contre le SARS-CoV-2 à l’aide d’au moins deux des tests sérologiques développés à l’Institut Pasteur.
Test S-Flow : ce test détecte la protéine du spicule du SARS-Cov-2 dans sa conformation naturelle, à la surface de la cellule. Il est très sensible et spécifique. Les résultats sont similaires à ELISA S, avec une sensibilité supérieure lorsque les taux d’anticorps sont faibles. Mais le test nécessite un appareillage de lecture particulier (cytomètre de flux), moins répandu que le lecteur de plaques dans les laboratoires d’analyse. Il est donc adapté à des activités de recherche épidémiologique plutôt qu’au diagnostic individuel à grande échelle.
Test LIPS : ce test dit « d’immunoprécipitation », utilise une technique différente des précédents et détecte les anticorps se fixant sur les protéines N ou S du SARS-Cov-2 ou leurs sous-domaines. Le test permet de caractériser de façon fine les régions des protéines virales cibles de la réponse anticorps. Le test utilise donc différents « antigènes cibles » de détection, et la sensibilité du test varie avec l’antigène détecté. Dans le cadre de cette étude une partie de N et une partie de S (S1) ont été utilisées. Par ailleurs ces tests sont utilisables sans modification chez la plupart des animaux
Les équipes de recherche ont par ailleurs développé deux tests dédiés à la recherche d’anticorps neutralisants dans le sérum des personnes infectées. Un test qui utilise du virus infectieux SARS-Cov-2, et nécessite un accès en laboratoire P3. Et un test avec un « pseudovirus » qui permet de travailler hors P3.
Le test de neutralisation avec le virus SARS-CoV-2 infectieux est plus fastidieux à mettre en œuvre car il nécessite une manipulation en laboratoire P3. Il utilise une dose fixe de virus qui détruit 100 % des cellules. Après mélange avec différentes dilutions de sérum, on observe si la présence d’anticorps anti-SARS-CoV-2 permet de neutraliser le virus et donc d’inhiber la multiplication virale et par conséquent d’empêcher la destruction des cellules.
Les équipes de recherche ont également mis au point un test de séro-neutralisation, appelé Lenti S, utilisant non pas le virus SARS-CoV-2 mais un pseudovirus non infectieux. Ce test ne nécessite donc pas de confinement en laboratoire de sécurité ce qui en assure une grande facilité de mise en œuvre à large échelle.
A l’inverse des tests de type ELISA qui détectent la présence d’anticorps, un test de séro-neutralisation mesure la capacité des anticorps à bloquer l’entrée du virus dans les cellules. Il permet donc de déterminer si une personne possède des anticorps capables de limiter la multiplication du virus et donc susceptibles de contribuer à la protection contre une nouvelle infection par le SARS-CoV-2. Les équipes de recherche souhaitent adapter ce test pour qu’il puisse être utilisé à très haut débit. D’autres travaux seront nécessaires pour déterminer la quantité d’anticorps neutralisants susceptible de contribuer à la protection, ainsi que leur persistance dans le temps.
Corrélation entre les tests
Pour évaluer la fiabilité des tests les uns par rapport aux autres, les équipes de recherche ont comparé les tests en utilisant les trois cohortes.
Chez les patients hospitalisés, un nombre à peu près similaire de cas positifs a été obtenu avec les tests sérologiques visant N ou S alors que la recherche d’anticorps anti-S1 est moins sensible dans cette application diagnostique, l’objectif de ce dernier test étant l’étude d’une corrélation avec la protection.
Avec la cohorte d’individus symptomatiques de l’Oise, le test S Flow, le test ELISA S, la combinaison LIPS N+S1 ont donné des résultats très proches et des taux de détection plus élevés que les autres tests. Chez les donneurs de sang, les cas positifs n’ont été détectés qu’avec les tests S Flow et le test ELISA S.
En conclusion :
1. Les équipes de recherche ont comparé les performances de 4 tests d’identification d’anticorps anti SARS-CoV-2. Globalement, ils fonctionnent très bien, avec des différences de sensibilité en fonction des tests et surtout des antigènes visés.
2. En ce qui concerne les tests d’identification d’anticorps neutralisants, le test de séro-neutralisation avec pseudovirus est simple et robuste mais il nécessite un équipement de culture cellulaire et des machines spéciales. Les tests sérologiques permettent d’estimer un taux d’anticorps se liant au virus sans préjuger de leur activité fonctionnelle.
3. Les chercheurs établissent actuellement des corrélations, qui permettront d’estimer, en fonction des taux d’anticorps se fixant sur différentes parties du virus, les échantillons de sang qui ont une activité neutralisante.
4. La présence d’anticorps neutralisants dans le sang est très probablement un signe que la personne est protégée contre une nouvelle infection, de manière d’autant plus importante que leur titre est élevé, mais cela n’a pas été encore formellement démontré.
5. Les tests de sérologie permettent de faire des études épistémologiques de séroprevalence sur des groupes donnés.
6. Le virus a bien circulé au sein du cluster de premiers cas, dans l’Oise : 32% de personnes avec signes cliniques modérés compatibles avec COVID-19 avaient des anticorps.
7. Concernant les tests chez les personnes asymptomatiques, les résultats dépendent des groupes étudiés et de leur localisation. Par exemple, les donneurs de sang asymptomatiques (les personnes ayant présenté des signes récents ne peuvent donner leur sang) dans l’Oise montrent 3 % de cas positifs parmi 200 cas testés.
« Ces tests servent à détecter la séroprévalence dans des études épidémiologiques et aussi à réaliser des diagnostics individuels. Ils sont également très utiles pour caractériser complètement des panels de sérums lors de l’évaluation des tests commerciaux. Cette étude a associé de nombreuses équipes de l’Institut Pasteur, qui ont travaillé en collaboration avec des médecins et virologistes de l’APHP, de l’INSERM, des épidémiologistes, l’EFS. Nous remercions les patients et les volontaires qui ont donné leur sang pour cette étude » soulignent Marc Eloit, Hugo Mouquet, Olivier Schwartz et Sylvie van der Werf, co-auteurs de cette étude.
« Les test ELISA N et ELISA S sont particulièrement intéressants dans le contexte actuel. A l’Institut Pasteur, il pourra être effectué plusieurs milliers de tests par semaine et la technique pourra être partagée avec d’autres laboratoires » explique quant à elle Sylvie van der Werf, responsable du Centre National de Référence des virus des infections respiratoires et co-dernière auteure de l’étude.
« Les tests de type LIPS ont une sensibilité équivalente pour un même antigène à des tests de type ELISA et sont adaptés à l’étude fine d’une probabilité de protection contre une nouvelle infection sur les cohortes de quelques milliers de sérums, pour définir les antigènes optimaux à utiliser pour des tests à très haut débit, ce qui correspond à une des demandes majeures pour la gestion du déconfinement. Depuis ces travaux, nous avons également étendu l’utilisation du test LIPS à la détection de l’infection par des coronavirus saisonniers et à la détermination de leur rôle dans la protection contre le SARS-CoV-2 ou sa facilitation » souligne Marc Eloit, responsable du laboratoire de Découverte de Pathogènes et co-dernier auteur de l’étude.
« Depuis le début de cette étude, en mars 2020, le test S-Flow est utilisé pour étudier l’importance de la réponse humorale chez les individus positifs à la PCR, présentant des symptômes bénins. Nous évaluons actuellement la durée de cette réponse. Nous analysons des échantillons d’individus convalescents collectés à différents points dans le temps après l’apparition des symptômes », explique Olivier Schwartz, responsable de l’unité Virus et immunité et co-dernier auteur de l’étude.