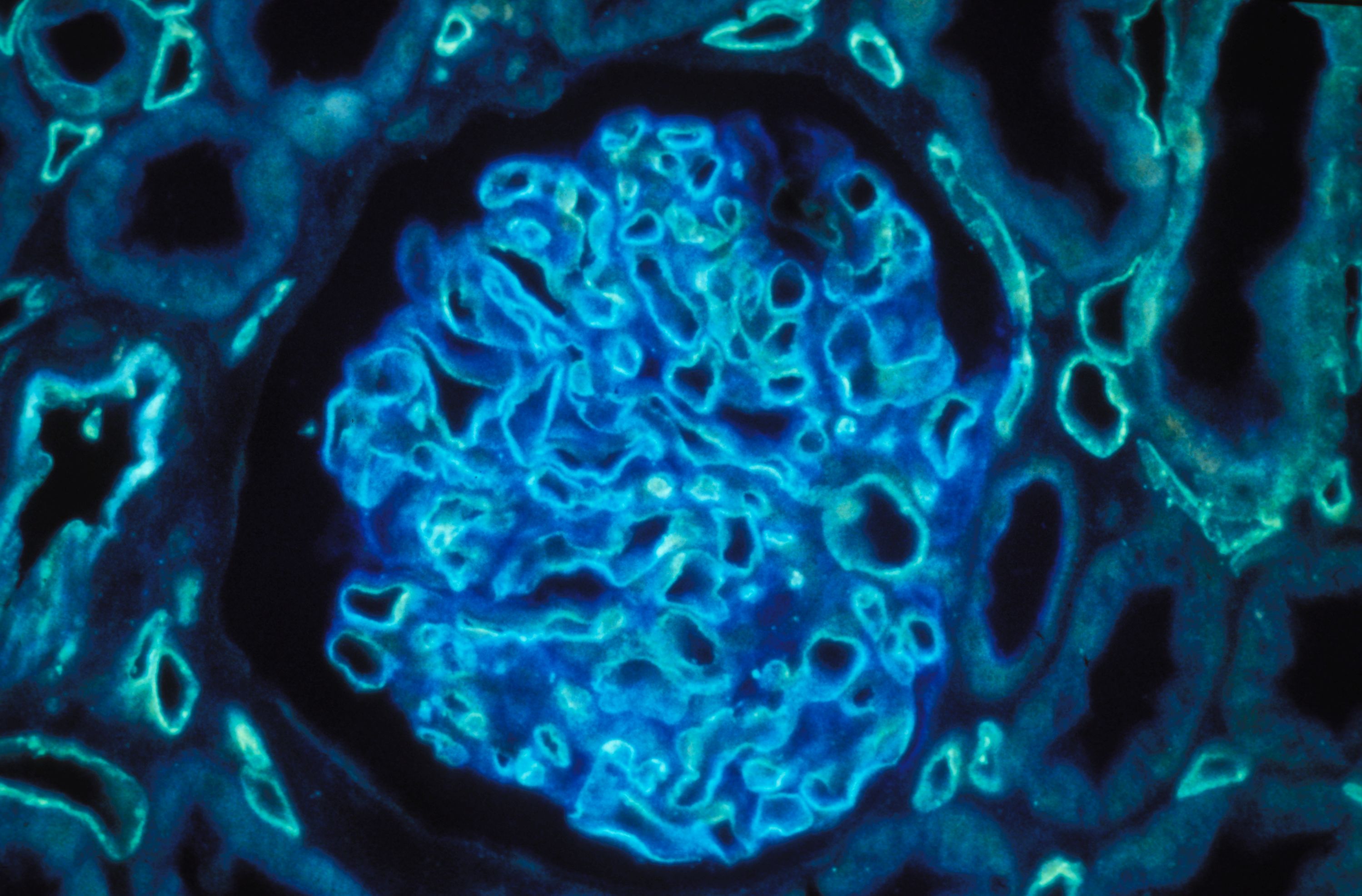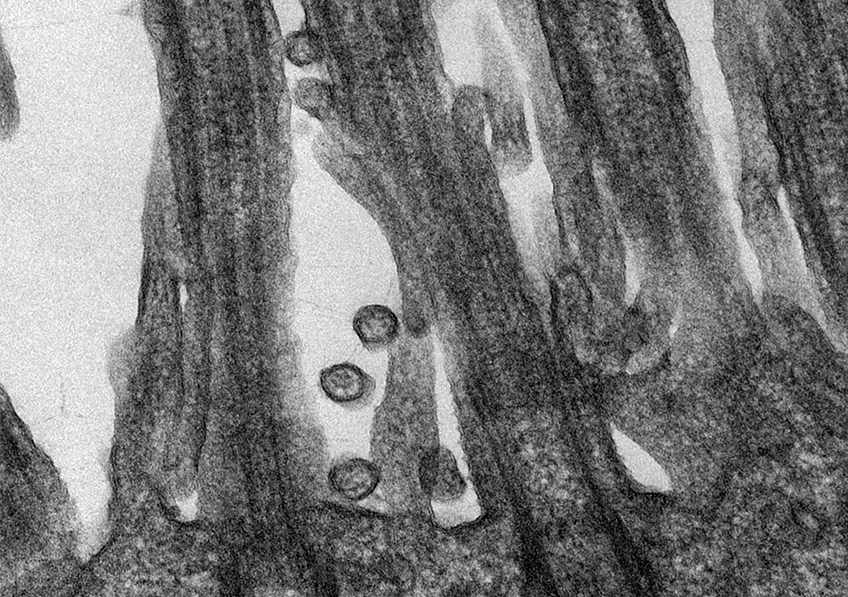
Coupe de rein humain grossie 400 fois par un microscope à immunofluorescence polychromatique. Inserm/Oriol, Rafael
Selon une nouvelle étude publiée le 31 août 2021 dans Lancet Public Health, portant sur 22 pays comprenant la plupart des pays européens et représentant environ 70% de l’activité de greffe mondiale, le nombre de transplantations d’organes solides réalisées lors de la première vague de la pandémie en 2020 a chuté de 31 % par rapport à l’année précédente et de plus de 15% sur l’ensemble de l’année 2020. Ce travail, sans précédent, qui évalue avec précision comment la Covid-19 a impacté tout un pan de la médecine, a été conduit par le professeur Alexandre Loupy (Université de Paris, Hôpital Necker-Enfants Malades AP-HP) et le docteur Olivier Aubert (Université de Paris, Hôpital Necker-Enfants Malades AP-HP), tous les deux également chercheurs au Centre Inserm de recherche translationnelle sur la transplantation d’organes de Paris (Paris Transplant Group).
Au début de la crise sanitaire de la Covid-19, les responsables des programmes de transplantation d’organes ont fait part de leurs préoccupations concernant la poursuite de l’activité de greffe d’organes solides durant l’épidémie. Deux raisons majeures à cela : le poids considérable de la prise en charge des patients Covid-19 pour le système de santé et les risques accrus d’infection pour les patients transplantés et donc immunodéprimés. Les recommandations ont donc été de ne maintenir dans la plupart des pays dans le monde que les transplantations urgentes, notamment les greffes de cœur et de foie, quand l’organisation hospitalière le permettait. Jusqu’à présent, aucune étude sur l’impact mondiale de la Covid-19 sur la transplantation d’organe solide n’avait été réalisée.
Dans leur étude, les auteurs se sont appuyés sur des données internationales des plus grandes institutions, Agence Biomédecine, NHS, UNOS, EUrotransplant…. qui ont été centralisées sur des serveurs sécurisés du Paris Transplant Group[i]. L’objectif de cette étude était d’étudier l’impact mondial de la pandémie sur la transplantation, de savoir si la réponse des différents pays était hétérogène et si ces décisions ont eu un impact sur la survie des patients en attente de greffons. Celle-ci a révélé une diminution globale de l’activité de greffe mais aussi d’importantes variations dans la réponse des programmes de transplantation lors de la pandémie de Covid-19, l’activité de transplantation ayant chuté de plus de 90% dans certains pays. Cette diminution, grâce à des calculs de modélisation statistiques, a démontré que cela correspondait à la perte de plus de 48 000 années de vie pour les patients.
Parallèlement l’étude montre que certains pays ont réussi à maintenir le rythme des procédures de transplantation, tandis que d’autres ont connu de fortes réductions par rapport à l’année précédente. Dans certaines régions, les transplantations de reins et de foies de donneurs vivants ont complétement cessé. Ces résultats incitent à une analyse plus approfondie au niveau régional, national et mondial pour expliquer ces disparités.
Par exemple, la transplantation rénale a connu la plus forte réduction dans presque tous les pays en 2020 par rapport à 2019 et plus précisément les transplantations de donneurs vivants ont nettement diminué (reins : -40 % ; foie : -33 %). En ce qui concerne les greffes à partir de donneurs décédés, il est observé une réduction des greffes de rein (-12 %), de foie (-9 %), de poumon (-17 %) et de cœur (-5 %).
Globalement la réduction du nombre de transplantations d’organes solides chez les personnes décédées ou vivantes est temporellement liée à l’augmentation du taux d’infection par le virus de la Covid-19.
Le Dr Olivier Aubert, médecin au Centre de recherche translationnelle sur la transplantation d’organes de Paris et auteur principal de l’étude, a déclaré : « La première vague de Covid-19 a eu un impact dévastateur sur le nombre de transplantations dans de nombreux pays, affectant les listes d’attente des patients et entraînant malheureusement une perte substantielle de vies humaines. »
Le professeur Alexandre Loupy, directeur du Centre Inserm de recherche translationnelle sur la transplantation d’organes de Paris et dernier auteur de l’étude, complète : « Il est clair que de nombreux décès indirects sont associés à la Covid-19 et notre étude confirme que la pandémie a des conséquences considérables sur de nombreuses spécialités médicales ».
Le nombre d’années de vie perdues pour l’ensemble des patients a été estimé à 37 664 ans pour les patients en attente d’un rein, 7 370 ans pour un foie, 1 799 ans pour un poumon et 1 406 ans pour un cœur, ce qui correspond à un total de 48 239 années de vie perdues.
Pour faciliter la compréhension des tendances temporelles et des conséquences de la pandémie sur les activités de transplantation d’organes solides à l’échelle mondiale, nationale et régionale pour les chercheurs, les cliniciens et les autorités de santé publique, les auteurs ont créé un tableau de bord en libre accès qui présente les données de manière interactive pour les activités de transplantation d’organes solides et les cas de Covid-19.
« Comprendre comment les différents pays et systèmes de santé ont répondu aux défis liés au Covid-19 peut faciliter l’amélioration de la préparation à une pandémie et la façon de maintenir en toute sécurité les programmes de transplantation pour fournir des procédures de sauvetage aux patients », conclut le Dr Olivier Aubert.
[i] Le Paris Transplant Group réunit une équipe multidisciplinaire dédiée à la transplantation et formée d’immunologistes, de médecins de laboratoire, de chercheurs, de néphrologues, de cardiologues, de pneumologues, de pathologistes, de statisticiens et de spécialistes de la santé publique.