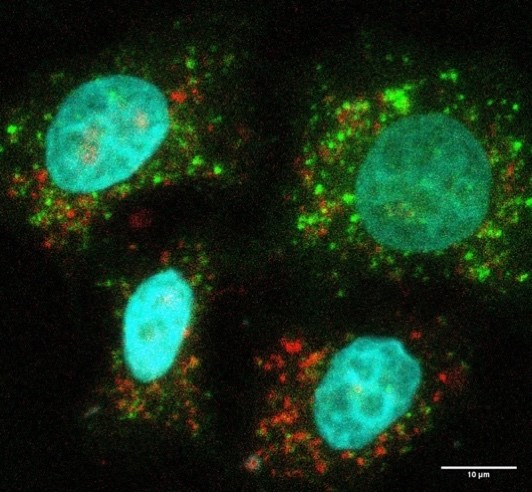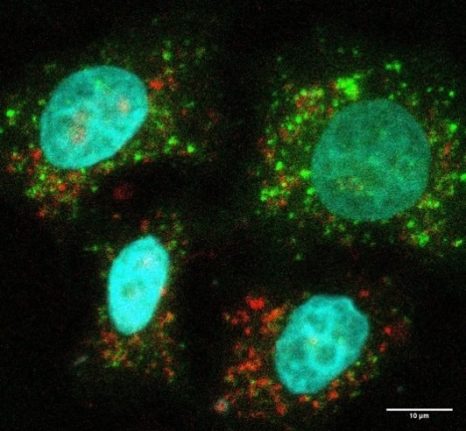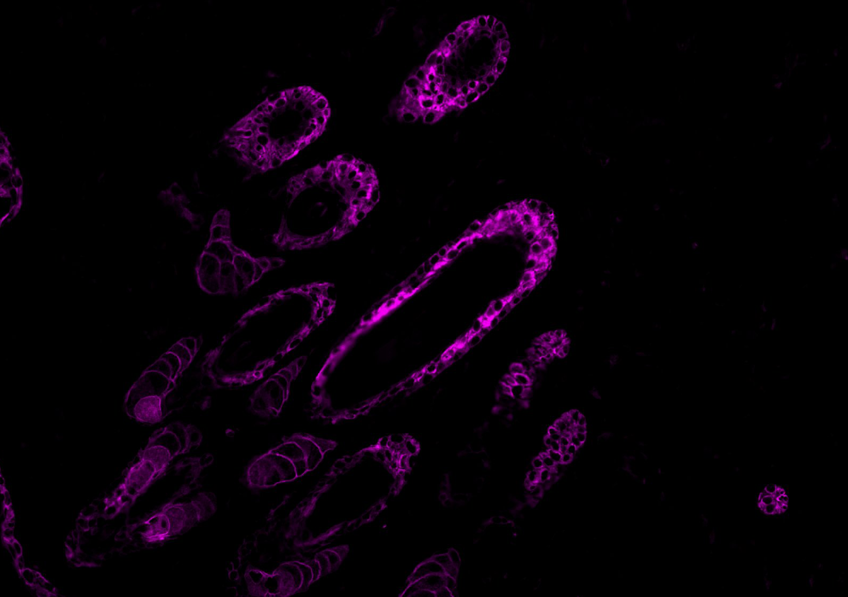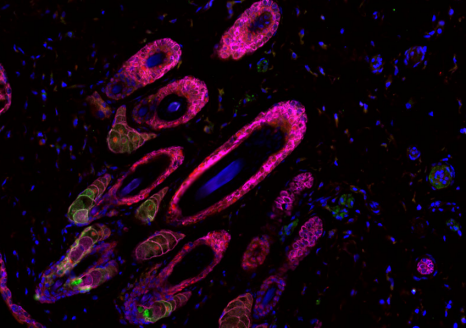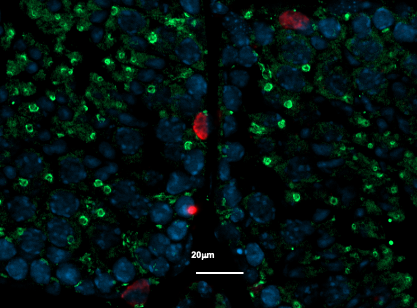
Image représentative d’un immunomarquage sur une coupe de testicule de souris. Le marquage rouge permet de visualiser les cellules germinales indifférenciées et le marquage vert correspond à la détection de la protéine GFP reflétant l’expression du récepteur TGR5 dans ce modèle d’étude. ©David Volle/Inserm
L’infertilité est un problème de santé publique affectant des millions de couples en France. Parmi les causes possibles, la chimiothérapie a été pointée du doigt comme ayant des effets particulièrement délétères sur la fertilité des femmes comme sur celle des hommes. Comprendre les mécanismes à l’origine de ces effets négatifs est une priorité afin de mieux les prévenir et de restaurer la fertilité chez les survivants du cancer. Dans une nouvelle étude, des chercheurs et chercheuses de l’Inserm, du CNRS et de l’université Clermont Auvergne se sont intéressés à un récepteur que l’on retrouve sur les cellules germinales masculine à l’origine des gamètes. L’objectif : mieux comprendre son rôle dans l’infertilité causée par une exposition à la chimiothérapie. Les résultats, publiés dans le journal Advanced Science, ouvrent la voie à une meilleure compréhension de l’infertilité masculine et au développement de traitements pour réduire les risques de stérilité en cas de chimiothérapie.
Près de 3,3 millions de Français sont directement touchés par l’infertilité. Celle-ci peut concerner aussi bien les hommes que les femmes et n’a cessé d’augmenter ces dernières années. Il s’agit aujourd’hui d’un problème de santé publique majeur[1].
Si les causes de l’infertilité sont nombreuses, il est actuellement bien établi que les traitements contre le cancer, et notamment la chimiothérapie, peuvent avoir des effets particulièrement délétères sur la fertilité masculine et féminine. Alors que les thérapies anticancéreuses ont connu des améliorations ces dernières années, il devient urgent de se pencher sur cette problématique, car un nombre croissant de survivants du cancer va être concerné par des problèmes d’infertilité.
Depuis près de 15 ans, le chercheur Inserm David Volle et son équipe au sein du laboratoire Génétique, reproduction et développement (Inserm/CNRS/Université Clermont Auvergne) tentent de mieux comprendre les mécanismes biologiques sous-jacents de l’infertilité. Une partie de leurs travaux s’intéresse à l’impact de la chimiothérapie sur la fertilité masculine, avec l’objectif à plus long terme d’identifier des pistes pour contrer les effets néfastes de ce traitement.
Dans leur nouvelle étude, les chercheurs et chercheuses se sont intéressés à des récepteurs présents à la membrane des cellules, appelés TGR5, pour comprendre leur rôle dans les effets délétères de la chimiothérapie.
Les récepteurs TGR5 sont très étudiés dans le contexte des maladies métaboliques comme le diabète et l’obésité. Ils sont en effet activés par les acides biliaires, des molécules produites au niveau du foie qui régulent certaines fonctions physiologiques, dont la glycémie et la dépense énergétique.
De précédents travaux de l’équipe avaient toutefois montré que ces récepteurs sont aussi présents au niveau des cellules germinales, les cellules à l’origine des gamètes. Dans des modèles de souris mimant une maladie hépatique, avec des taux d’acides biliaires élevés, les scientifiques avaient constaté que les récepteurs TGR5 sur les cellules germinales étaient activés, ce qui était associé à une augmentation de la stérilité chez les animaux.
Mort des cellules germinales
Pour aller plus loin et comprendre l’impact des TGR5 sur la fertilité dans le contexte de la chimiothérapie, les scientifiques ont ici exposé des souris à un agent de chimiothérapie appelé busulfan. Ils ont alors montré que la chimiothérapie induit la mort d’une partie des cellules germinales chez des souris saines, affectant ainsi leur fertilité. « Le fait que ce soit les cellules germinales, encore indifférenciées, qui soient touchées est particulièrement problématique car l’on touche à la réserve des cellules produisant les gamètes. Cela peut réduire leur renouvellement et contribuer à l’infertilité post-chimiothérapie », souligne David Volle.
En revanche, chez des souris qui ont été génétiquement modifiées pour que les récepteurs TGR5 soient absents, les effets de la chimiothérapie sur les cellules germinales sont atténués. Cela se traduit par un retour accéléré de la fertilité chez ces souris traitées au busulfan par rapport aux souris témoins.
« Notre étude a donc permis de mieux comprendre les mécanismes moléculaires impliqués dans les impacts délétères des chimiothérapies sur les cellules germinales et la fertilité. En effet, ces résultats démontrent que les récepteurs TGR5 jouent un rôle important dans les effets délétères de la chimiothérapie sur l’infertilité », ajoute David Volle.
A plus long terme, l’objectif serait de développer des méthodes pour moduler l’activation des récepteurs TGR5 de manière ciblée au sein des cellules germinales, afin de protéger ces dernières et de restaurer la fertilité après la chimiothérapie.
L’idée serait aussi d’évaluer si ces données peuvent être extrapolées dans d’autres contextes pathologiques où l’activité des récepteurs TGR5 pourrait être modulée telles que l’obésité ou le diabète, des pathologies connues pour altérer la fertilité.
Par ailleurs, en parallèle de ces travaux, l’équipe a constaté que même lorsque la fertilité était maintenue chez les souris exposées à la chimiothérapie, la qualité des gamètes était affectée. Les scientifiques s’attachent donc désormais à comprendre les impacts sur les cellules germinales tant au niveau quantitatif que qualitatif pour limiter les troubles de la fertilité, mais également les conséquences à plus long terme sur la descendance des animaux.
[1] La publication d’un rapport demandé par le ministre de la Santé et le secrétaire d’Etat chargé de l’Enfance et des Famille, en Février 2022 dessine les contours d’une stratégie nationale de lutte contre l’infertilité : https://solidarites-sante.gouv.fr/IMG/pdf/rapport_sur_les_causes_d_infertilite.pdf