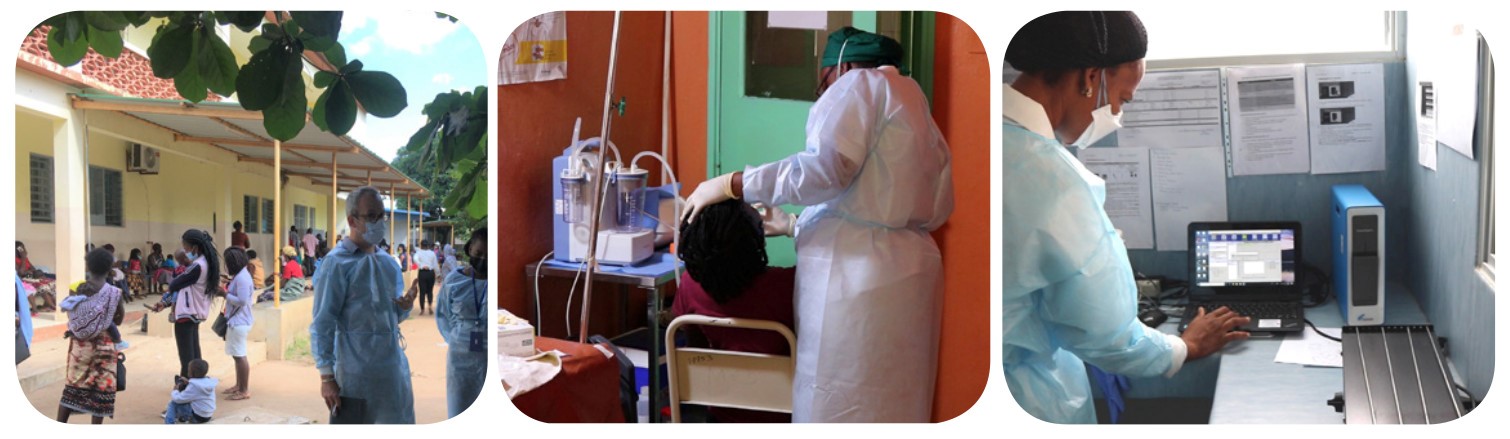
Dans les pays à forte incidence de tuberculose, la maladie peut être une cause de pneumonie sévère de l’enfant et contribuer à sa mortalité chez les plus jeunes d’entre eux. © TB-Speed
La tuberculose touche 1 million d’enfants chaque année dont moins de la moitié sont diagnostiqués et traités, ce qui entraîne plus de 200 000 décès par an. Dans une nouvelle étude, des chercheurs et cliniciens de l’Université de Bordeaux, de l’Institut de recherche pour le développement (IRD) de l’Inserm et MU-JHU (collaboration de recherche entre l’Université de Makerere et l’Université de John Hopkins en Ouganda) regroupés au sein du consortium TB-Speed, ont montré que le dépistage de la tuberculose à l’admission des enfants souffrant de pneumonie sévère était faisable.
Par ailleurs, un tel dépistage avec un test appelé l’Xpert Ultra permettrait d’améliorer le diagnostic de la tuberculose chez les enfants des pays à forte incidence de la maladie. Les résultats de l’étude plaident en faveur d’une utilisation plus systématique de l’Xpert Ultra, chez ces enfants, notamment chez ceux souffrant de malnutrition aiguë sévère. Ils confirment enfin l’importance de la tuberculose comme cause de pneumonie sévère de l’enfant. Les résultats sont publiés depuis le 15 novembre 2022 dans The Lancet Infectious Diseases.
Dans les pays à forte incidence de tuberculose, la maladie peut être une cause de pneumonie sévère de l’enfant et contribuer à sa mortalité chez les plus jeunes d’entre eux. Habituellement, le diagnostic de la tuberculose n’est envisagé que chez les enfants présentant des symptômes prolongés, chez ceux en échec d’un ou plusieurs traitements antibiotiques d’une pneumonie communautaire ou chez ceux avec une histoire de contact avec une personne malade. Ainsi, de nombreux cas de tuberculose ne sont pas identifiés ou sont diagnostiqués tardivement, augmentant le risque de mauvaise évolution et de décès.
Or, les enfants présentant une pneumonie liée à la tuberculose ont très souvent des symptômes aigus et ne sont pas considérés comme des cas présomptifs de tuberculose. Dans ce contexte, le consortium TB-Speed a émis l’hypothèse qu’un dépistage de la tuberculose chez les jeunes enfants admis pour une pneumonie sévère suivi d’un traitement rapide pour ceux dont le dépistage est positif, pourrait réduire la létalité des pneumonies sévères liées à la tuberculose.
TB-Speed Pneumonia est le premier essai international randomisé en grappes à grande échelle visant à évaluer l’effet d’un dépistage moléculaire de la tuberculose en plus du traitement standard de l’Organisation mondiale de la Santé (OMS) chez les enfants admis pour une pneumonie grave. L’étude, financée par Unitaid et l’Initiative, et promue par l’Inserm, a été menée dans 16 hôpitaux tertiaires de six pays à forte incidence de tuberculose (Côte d’Ivoire, Cameroun, Ouganda, Mozambique, Zambie et Cambodge).
Elle a évalué l’impact sur la mortalité d’une détection moléculaire systématique de la tuberculose à l’aide du test diagnostique moléculaire rapide Xpert MTB/RIF Ultra (Ultra) réalisé sur un échantillon d’aspiration nasopharyngée et un échantillon de selles, rajoutée au standard de soins recommandée par l’OMS pour les pneumonies sévères (qui comprend un traitement antibiotique à large spectre, de l’oxygène si indiqué et le traitement des comorbidités comme l’infection par le VIH et la malnutrition grave). Les hôpitaux ont été randomisés pour commencer progressivement les tests moléculaires et le flux des échantillons été organisé de manière à réduire le délai d’obtention des résultats à 3 heures. Tous les enfants ayant des résultats ultra positifs ont été immédiatement mis sous traitement antituberculeux. Les enfants ont été suivis pendant 12 semaines après l’enrôlement.
Au total, 2 570 enfants ont été inclus dans l’étude (1401 dans le bras de contrôle et 1169 dans le bras d’intervention) entre mars 2019 et mars 2021. 95 % des enfants ont eu des aspirations nasopharyngées et 80 % ont eu des selles recueillies et testées avec le test Ultra.
Bien que ce dépistage n’ait pas permis de réduire la mortalité toutes causes confondues à 12 semaines de suivi par rapport au standard de soins, il a augmenté le nombre d’enfants diagnostiqués pour la tuberculose et notamment ceux avec une confirmation microbiologique et il a réduit le délai d’instauration du traitement.
De plus, la létalité et le taux de détection de la tuberculose étaient quatre à cinq fois plus élevés dans le sous- groupe des enfants souffrant de malnutrition aiguë sévère par rapport aux autres enfants. L’étude a aussi montré que collecter et tester avec Xpert Ultra des échantillons nasopharyngés et des échantillons de selles était faisable chez des enfants très vulnérables et était bien toléré.