Contact Chercheur
Jean-Charles Guéry
U 1043 – Centre de Physiopathologie de Toulouse-Purpan – CPTP
+33 (0)5 62 74 83 78
José-Enrique Mejía
U 1043 – Centre de Physiopathologie de Toulouse-Purpan – CPTP
+33 (0)5 62 74 45 17
Fusion de macrophages infectés par le VIH © Inserm/Institut Curie/Gaudin, Raphaël/Bernaroch, Philippe
Pour la première fois, une équipe de recherche a mis en évidence un mécanisme génétique dépendant du sexe dans la réponse immunitaire innée qui a lieu lors de la phase aiguë de l’infection par le VIH-1.
Ces travaux, publiés dans JCI Insight le 18 juin, soutenus par l’ANRS, viennent éclairer d’une façon nouvelle les différences de charge virale entre les hommes et les femmes dans le premier stade de l’infection par le VIH-1, déjà observées précédemment. Cette publication contribue à une meilleure compréhension des mécanismes de l’infection par le VIH-1, qui reste un problème de santé mondiale avec 1,7 million de personnes nouvellement infectées en 2018 dans le monde*.
Ces travaux ont été menés par l’équipe de Jean-Charles Guéry (Centre de physiopathologie de Toulouse Purpan, Université de Toulouse III-Paul Sabatier, Inserm, CNRS), en collaboration avec Laurence Meyer (Centre de recherche en épidémiologie et santé des populations, Inserm, Université Paris-Saclay), Pierre Delobel (Service des maladies infectieuses et tropicales, CHU de Toulouse, Inserm) et Michaela Müller-Trutwin (Unité HIV, inflammation et persistance, Institut Pasteur).
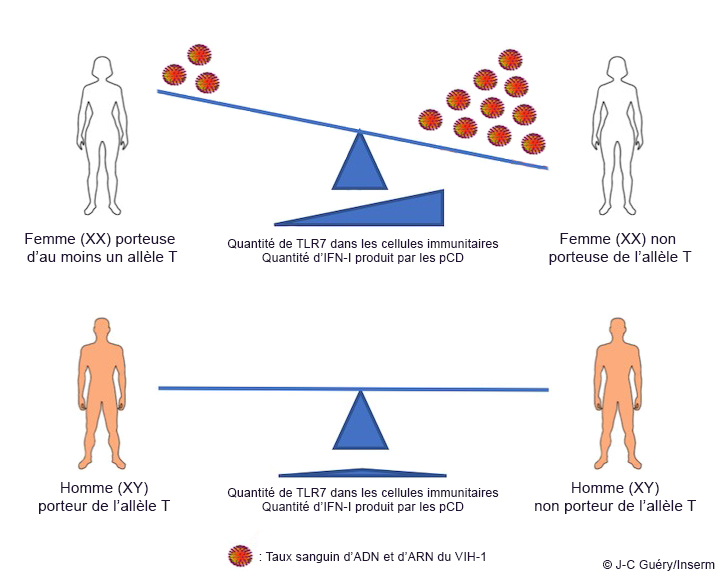
Afin de comprendre les différences de charge virale observées dans la phase aiguë de l’infection par le VIH chez les femmes et les hommes, les chercheurs se sont intéressés à des cellules centrales dans la réponse immunitaire innée en cas d’infection virale : les cellules dendritiques plasmacytoïdes (pDC, pour plasmacytoid dendritic cells). Ces dernières possèdent des récepteurs appelés « TLR7 ». Lorsque de l’ARN viral se fixe sur ce récepteur, les pDC sécrètent alors de grandes quantités de molécules, telles que l’interféron de type I (IFN-I). L’IFN-I possède à la fois une activité antivirale et des propriétés régulatrices de la réponse immunitaire. Le gène codant pour le récepteur TLR7 se situe sur le chromosome X. Ce chromosome est possédé en deux copies par les femmes (XX) et une seule chez les hommes (XY). Chez les femmes, afin de ne pas surexprimer les gènes du chromosome X, un mécanisme inactive les gènes portés par l’un des deux chromosomes. Or, la même équipe a montré en 2018 que le gène codant pour TLR7 échappait à cette inactivation. Ainsi, le récepteur est présent en quantité significativement plus importante chez les femmes que chez les hommes.
Ici, les auteurs ont étudié un variant fréquent du gène codant pour le TLR7, l’allèle « T ».
En conclusion, les scientifiques indiquent que « TLR7 est une molécule effectrice clé qui, quand elle est surexprimée, exerce un effet délétère sur la charge virale dans l’infection aiguë par le VIH-1. Ces résultats sont inattendus, car ils suggèrent que l’IFN-I, moins sécrété chez les porteuses de l’allèle T du gène codant pour TLR7, n’est pas responsable du meilleur contrôle de la charge virale, comme de nombreuses hypothèses le suggéraient jusqu’à présent. Cette molécule jouerait même un rôle délétère dans la phase aiguë de l’infection si ses niveaux sont trop élevés. Dorénavant, les études des mécanismes immunitaires, ainsi que les stratégies visant à réduire les réservoirs viraux à l’aide de molécules capables de se lier spécifiquement au récepteur TLR7, devront tenir compte de cette découverte. »
* Source : ONUSIDA 2019 (www.unaids.org/fr/resources/fact-sheet)
Cohorte ANRS CO6 PRIMO
Initiée en 1996, la cohorte ANRS CO6 PRIMO a inclus à ce jour 2 426 patients vivant avec le VIH-1 depuis moins de trois mois. Son objectif principal est d’améliorer les connaissances physiopathologiques sur la primo-infection VIH. Elle permet désormais d’apporter des informations sur l’impact des traitements précoces dès la primo-infection, transitoires ou prolongés, par rapport à un traitement différé sur le pronostic à long terme ; sont ainsi étudiés des marqueurs de l’inflammation et la baisse des réservoirs viraux.
Jean-Charles Guéry
U 1043 – Centre de Physiopathologie de Toulouse-Purpan – CPTP
+33 (0)5 62 74 83 78
José-Enrique Mejía
U 1043 – Centre de Physiopathologie de Toulouse-Purpan – CPTP
+33 (0)5 62 74 45 17
TLR7 dosage polymorphism shapes interferogenesis and HIV-1 acute viremia in women
Pascal Azar1, José-Enrique Mejía1, Claire Cenac1, Arnoo Shaiykova2, Ali Youness1, Sophie Laffont1, Asma Essat2, Jacques Izopet1,3, Caroline Passaes4, Michaela Müller-Trutwin4, Pierre Delobel1,5, Laurence Meyer2 et Jean-Charles Guéry1
1Centre de Physiopathologie de Toulouse Purpan (CPTP), Université de Toulouse, UMR 1043 Inserm, CNRS, Toulouse, France 2Centre de Recherche en Epidémiologie et Santé des Populations (CESP), Université Paris-Sud, Université Paris-Saclay, Inserm, Le Kremlin-Bicêtre, France 3Laboratoire de Virologie, CHU Purpan, Toulouse, France 4Institut Pasteur, Unité HIV Inflammation et Persistance, Paris, France 5Service des Maladies Infectieuses et Tropicales, CHU Purpan, Toulouse, France
JCI Insight https://doi.org/10.1172/jci.insight.136047