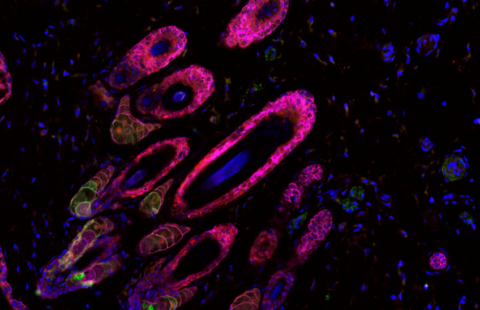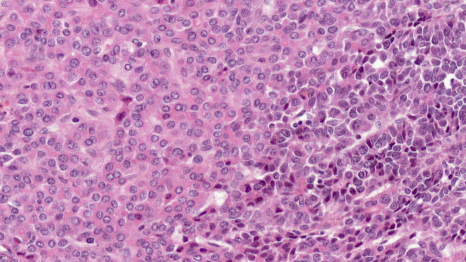
Diversité de cellules au sein d’une même tumeur. Visualisation au microscope (avec une coloration à l’hématoxyline et à l’éosine) pour des hépatoblastomes. ©Dr Guillaume Morcrette
Le mois de Septembre ou « Septembre en Or » est dédié au soutien à la lutte contre les cancers pédiatriques, première cause de décès chez l’enfant. Chaque année en France, environ 1700 enfants de moins de 15 ans déclarent la maladie[1]. Les chercheurs de l’Inserm sont plus que jamais mobilisés pour faire avancer la recherche contre le cancer et s’intéressent notamment à élucider les mécanismes d’initiation des tumeurs chez l’enfant, pour mieux comprendre la maladie, sa progression et permettre la découverte de nouveaux traitements. Retour sur deux études récentes publiées sur le sujet dans la revue Cancer Discovery.
Pourquoi certaines leucémies touchent-elles uniquement les enfants ?
Un tiers des cancers pédiatriques diagnostiqués en France sont des leucémies[2], communément appelées cancers du sang. Les leucémies aiguës myéloïdes (LAM) représentent 15% des leucémies diagnostiquées chez les enfants et adolescents. Leur pronostic est souvent mauvais puisque la survie globale demeure autour de 60 % à cinq ans.
Dans une étude publiée dans la revue Cancer Discovery, l’équipe du chercheur Thomas Mercher, directeur de recherche de l’équipe « Génétique et modélisation des leucémies de l’enfant », s’est intéressée aux mécanismes d’initiation de la leucémie aiguë myéloïdes chez l’enfant, et plus particulièrement de la leucémie aiguë mégacaryoblastique (LAM7), une forme très agressive de LAM.
L’équipe est notamment parvenue à montrer que la fusion de deux protéines normalement indépendantes dans la cellule, appelée ETO2-GLIS2, est suffisante pour induire rapidement des leucémies agressives, si elle est activée dans des cellules hématopoïétiques du fœtus[3]. En revanche, son activation dans des cellules adultes est faiblement associée au développement de leucémie.
Des résultats qui suggèrent que certaines leucémies se développent spécifiquement chez les enfants car les cellules fœtales présentent des propriétés différentes par rapport aux cellules adultes. Ils permettent également de proposer de nouveaux mécanismes à cibler dans les cellules fœtales et dans les leucémies de l’enfant afin d’améliorer les traitements chez ces patients.
Pourquoi un enfant sur cinq atteint d’un cancer du foie exprime une résistance à la chimiothérapie ?
Une autre étude publiée dans la revue Cancer Discovery, s’est quant à elle intéressée aux mécanismes d’initiation et de progression des cancers du foie chez l’enfant. Les cancers du foie représentent environ 1% de l’ensemble des tumeurs de l’enfant. L’hépatoblastome est le type de tumeur maligne hépatique le plus fréquent, avec une incidence d’un cas pour un million d’enfants de moins de 15 ans, soit 10 à 15 nouveaux cas par an en France, survenant principalement avant l’âge de 2 ans.
Grâce à la caractérisation précise de la diversité moléculaire et génomique des tumeurs du foie pédiatrique, l’étude de l’équipe du Professeure Jessica Zucman-Rossi au Centre de Recherche des Cordeliers (Université de Paris, Inserm, Sorbonne Université), et ses collaborateurs du réseau Hepatobio, a permis non seulement de mieux comprendre l’origine du développement des cancers, les phénomènes de plasticité cellulaire à l’origine des cas de résistance mais également d’explorer de nouvelles pistes thérapeutiques afin de proposer un traitement aux enfants qui ne répondent pas à la chimiothérapie (environ un sur cinq).
- Les chercheurs ont caractérisé de nouvelles mutations (altérations fréquentes d’une région du chromosome 11) à l’origine du développement des hépatoblastomes
- Ils ont montré que, dans quasiment tous les cas, la transformation maligne en cancer était liée à l’activation de l’oncogène ß-caténine associée à des mutations rares d’autres gènes (NFE2L2, TERT, GPC3, RPS6KA3 ou CREBBP).
- Ils ont mis en évidence l’extraordinaire plasticité des cellules tumorales dans les hépatoblastomes, en montrant qu’il peut exister quatre sous-populations cellulaires au sein d’une même tumeur.
- Enfin, ils ont montré qu’une population de cellules, appelées « cellules de type progéniteur », accumulent des mutations génétiques lors de l’exposition au cisplatine, molécule faisant partie de la chimiothérapie, et que cette accumulation de mutations est associée à la résistance à la chimiothérapie et donc aux rechutes après chimiothérapie.
En cherchant à cibler spécifiquement ces cellules de « type progéniteur », l’équipe a pu identifier de nouveaux traitements candidats permettant de surmonter la résistance au cisplatine dans des expériences in vitro et chez la souris, qui restent à confirmer chez les patients.
L’Inserm, plus que jamais mobilisé dans la recherche contre le cancer
Bien que le diagnostic et le traitement des cancers aient fortement évolué ces dernières décennies, d’immenses progrès sont encore indispensables pour mieux comprendre les maladies tumorales et d’améliorer le pronostic. Il est donc crucial de soutenir les travaux de recherche qui permettent de progresser dans la compréhension des mécanismes de développement des cancers. Les équipements disponibles dans les laboratoires, et tout particulièrement les plateformes de recherche, sont essentiels pour atteindre cet objectif.
Dans ce contexte, l’Itmo Cancer d’Aviesan organise un appel à projets, avec l’objectif de permettre l’acquisition d’équipement mutualisé semi-lourd ou lourd, en favorisant les interactions entre les équipes et en renforçant l’attractivité et la place des équipes françaises sur la scène internationale.
Pour en savoir plus et consulter l’appel à projets
- Ouverture : 21 septembre 2021
- Date limite de candidature : 2 décembre 2021, 17h
[1] Registre National des Cancers de l’Enfant
[2] Parmi les cancers pédiatriques : Leucémies 29 % des cas, dont 80 % de leucémies aiguës lymphoblastiques, tumeurs du système nerveux central 25 %, lymphomes 10 %.
[3] Pour réaliser ces travaux, les chercheurs ont analysé les caractéristiques de cellules leucémiques humaines et développé un modèle murin permettant d’étudier l’expression de la fusion ETO2-GLIS2.