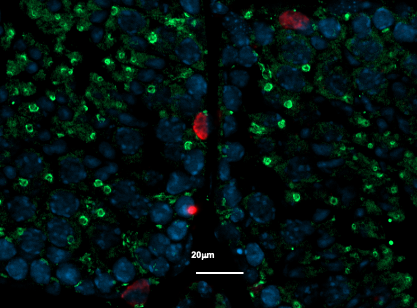
Souche de bifidobactérie isolée de la microflore intestinale
© Inserm/U510
Deux espèces bactériennes présentes dans l’intestin boostent l’efficacité des chimiothérapies à base de cyclophosphamide en optimisant l’immunité anti-tumorale induite par ce médicament. C’est ce qu’affirment des chercheurs de l’Inserm, de Gustave Roussy, du CNRS, de l’Institut Pasteur de Lille, et des universités Paris Sud et de Lille dans un article publié le 4 octobre dans la revue Immunity.
Des études récentes ont montré que certains microbes intestinaux favorisent la croissance de tumeurs, tandis que d’autres contribuent à rendre plus efficaces des traitements anti-cancéreux. Il restait à identifier la nature et le mode d’action des espèces bactériennes capables d’optimiser la réponse anti-tumorale induite par la chimiothérapie.
Dans cette nouvelle étude, Mathias Chamaillard[1], Laurence Zitvogel[2] et leurs collaborateurs, ont montré que deux bactéries intestinales, E. hirae et B. intestinihominis, potentialisent ensemble les effets thérapeutiques anticancéreux du cyclophosphamide, une chimiothérapie utilisée dans le traitement de nombreux cancers.
Comment ? La chimiothérapie entraine des effets secondaires parmi lesquels une plus forte porosité de la barrière intestinale et, par voie de conséquence, le passage des bactéries constitutives du microbiote dans la circulation sanguine. Pour lutter contre ce passage anormal des bactéries dans la circulation, une réponse immunitaire se déclenche. Contre toute attente, cette réponse est bénéfique pour les patients car elle peut entraîner aussi la destruction des cellules tumorales. La tumeur est donc attaquée directement par le traitement de cyclophosphamide et indirectement par cet effet « boostant » des bactéries.
Plusieurs modèles précliniques ont permis aux chercheurs de démontrer que la réponse immunitaire anti-tumorale induite par le cyclophosphamide est optimisée après l’administration par voie orale de E. hirae. Un traitement par voie orale par B. intestinihominis a permis d’obtenir un effet similaire.
Ensuite, les chercheurs ont analysé le profil immunitaire des lymphocytes sanguins de 38 patients atteints d’un cancer du poumon ou de l’ovaire à un stade avancé et traités par chimio-immunothérapie. Ils ont découvert que la présence de lymphocytes T mémoires spécifiques de E. hirae et B. intestinihominis permet de prédire la période pendant laquelle un patient vit avec un cancer sans qu’il ne s’aggrave, pendant et après un traitement.
« L’efficacité d’un médicament anticancéreux repose sur une interaction complexe entre le microbiome du patient et sa capacité à élaborer une mémoire immunitaire efficace contre certaines bactéries du microbiote intestinal », explique l’un des principaux auteurs de l’étude, Mathias Chamaillard, Directeur de recherche Inserm.
« Ces résultats nous permettent d’envisager une meilleure efficacité de ces traitements en optimisant l’utilisation des antibiotiques, mais également par la mise en place d’une supplémentation de certaines bactéries qualifiées d’onco-microbiotiques (ou de leurs principes actifs) capables de renforcer l’efficacité des anticancéreux ».
Les chercheurs ont prévu d’identifier, dans le cadre d’études ultérieures, les parties spécifiques des bactéries responsables du renforcement des effets du cyclophosphamide. « Si nous arrivons à répondre à cette question, nous pourrons peut-être trouver une manière d’améliorer la survie des patients traités par cette chimiothérapie en leur administrant des médicaments dérivés de ces bactéries.», conclut Mathias Chamaillard.
[1] Unité 1019 « Centre d’infection et d’immunité de Lille » (Inserm/CNRS/Université de Lille/Institut Pasteur de Lille)
[2] Unité 1015 « Immunologie des tumeurs et immunothérapie » (Inserm/Institut Gustave Roussy/Université Paris-Sud)