Contact Chercheur
Sophie Lotersztajn
Centre de recherche sur l’inflammation (Inserm/Université Paris Cité)
E-mail : fbcuvr.ybgrefmgnwa@vafrez.se
Téléphone sur demande
La cirrhose constitue le dernier stade évolutif de la fibrose associée aux maladies chroniques du foie. Elle touche 200 000 à 500 000 individus en France et est responsable de 170 000 décès par an en Europe. © Adobe Stock
Les maladies chroniques du foie sont caractérisées par une inflammation persistante qui contribue à leur progression vers des stades plus sévères. Elles peuvent évoluer vers une fibrose et une cirrhose, et alors nécessiter une transplantation de foie. Limiter la progression de la fibrose et la faire régresser est donc un enjeu thérapeutique important. Plusieurs études ont récemment suggéré que cibler la réponse inflammatoire pourrait être une approche intéressante. Dans de nouveaux travaux, des scientifiques de l’Inserm et d’Université Paris-Cité au Centre de Recherche sur l’Inflammation (CRI), en collaboration avec des équipes de l’AP-HP[1], ont montré que bloquer l’activation d’une population particulière de lymphocytes T, les lymphocytes associés aux muqueuses (MAIT), pourrait permettre de stopper la progression de la fibrose et même de la faire régresser. Cibler les cellules MAIT, qui sont impliquées dans l’inflammation observée dans les fibrose et cirrhose, ouvrirait ainsi de nouvelles perspectives pour une meilleure prise en charge thérapeutique des patients. Cette étude fait l’objet d’une publication dans la revue Nature Communications.
Principalement d’origine alcoolique, virale ou métabolique, la cirrhose constitue le dernier stade évolutif de la fibrose associée aux maladies chroniques du foie. Elle touche 200 000 à 500 000 individus en France et est responsable de 170 000 décès par an en Europe. À terme, elle aboutit à une insuffisance hépatique, dont le seul traitement curatif est la transplantation.
Une caractéristique des maladies chroniques du foie est une inflammation persistante qui contribue à leur progression vers des stades plus sévères, et notamment l’évolution vers la fibrose et son stade ultime, la cirrhose. Mieux comprendre comment réguler cette réponse inflammatoire constitue donc un enjeu important pour développer de nouvelles stratégies thérapeutiques contre ces pathologies.
En 2018, l’équipe de la chercheuse Inserm Sophie Lotersztajn avait montré qu’une population de lymphocytes T appelée MAIT favorisait la progression de la fibrose du foie. Ces cellules immunitaires sont particulièrement abondantes dans le foie humain et sont impliquées dans les processus inflammatoires associés à la fibrose.
Dans leur nouvelle étude, la scientifique et ses collègues ont travaillé à partir d’échantillons de foie de patients cirrhotiques ainsi que de modèles murins de la maladie.
Leurs travaux montrent que l’administration d’un agent pharmacologique inhibant l’activation des cellules MAIT permet de limiter l’inflammation hépatique et de stopper non seulement la progression de la fibrose, mais également de la faire régresser.
Il est aujourd’hui bien connu que d’autres cellules immunitaires, comme les macrophages, jouent un rôle central dans la progression et la régression de fibrose. Ici, l’analyse des mécanismes impliqués a permis de montrer que le fait de bloquer l’activation des cellules MAIT interrompt leur dialogue avec les macrophages « pro-fibrogéniques », c’est-à-dire accélérateurs de la fibrose, et favorise l’émergence de macrophages résolutifs de la fibrose.
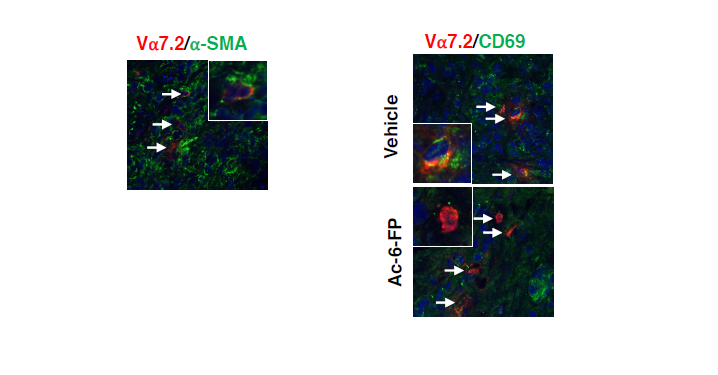
Dans la première image, les cellules MAIT (en rouge, désignées par les flèches) sont localisées près des cellules fibrogéniques (en vert) dans le foie de patients cirrhotiques. Dans la deuxième image, les cellules MAIT (en rouge) sont activées (marqueur d’activation en vert) dans le foie de patients cirrhotiques. Cette activation est bloquée en présence d’un inhibiteur des cellules MAIT. © Sophie Lotersztajn
« La cirrhose est un problème majeur de santé publique. Alors que le seul traitement est la transplantation de foie, notre travail permet d’ouvrir d’autres pistes thérapeutiques pour cibler l’inflammation et parvenir à stopper, voire même à faire régresser la fibrose. Il faut maintenant poursuivre les recherches, notamment pour développer des candidats médicaments ciblant et inhibant les MAIT », conclut Sophie Lotersztajn.
[1] Ce travail est le fruit d’une collaboration entre l’équipe des Drs Sophie Lotersztajn et Hélène Gilgenkrantz, (centre de recherche sur l’inflammation (CRI) Inserm-Université Paris Cité), l’équipe du Dr Valérie Paradis au CRI (également service de Pathologie hôpital Beaujon), le service d’anesthésie-réanimation (Pr Emmanuel Weiss), les équipes de l’Institut Curie (Dr Olivier Lantz), de l’Institut St Louis (Dr Michèle Goodhardt) et Génosplice (Dr Pierre de la Grange)
Sophie Lotersztajn
Centre de recherche sur l’inflammation (Inserm/Université Paris Cité)
E-mail : fbcuvr.ybgrefmgnwa@vafrez.se
Téléphone sur demande
MAIT cell inhibition promotes liver fibrosis regression via macrophage phenotype reprogramming
Morgane Mabire1, Pushpa Hegde1, Adel Hammoutene1,7, Jinghong Wan1,7, Charles Caër1,7, Rola Al Sayegh1, Mathilde Cadoux1, Manon Allaire1, Emmanuel Weiss1,2, Tristan Thibault-Sogorb1,2, Olivier Lantz3, Michèle Goodhardt4, Valérie Paradis1,5, Pierre de la Grange6, Hélène Gilgenkrantz1 & Sophie Lotersztajn1
1 Université Paris Cité, INSERM, UMR-S1149, Centre de Recherche sur l’Inflammation (CRI), Laboratoire d’Excellence Inflamex, F-75018 Paris, France.
2 Département d’Anesthésie et Réanimation, Hôpital Beaujon, Assistance Publique-Hôpitaux de Paris, 92110 Clichy, France.
3 Institut Curie, INSERM U932, Paris, France.
4 Université Paris Cité, INSERM UMRS 976, Institut de Recherche Saint Louis, F-75010 Paris, France.
5 Département de Pathologie, HôpitalBeaujon, Assistance Publique-Hôpitaux de Paris, 92110 Clichy, France.
6 GenoSplice, Paris, France.
7 These authors contributed equally
Nature Communication, avril 2023