Contact Chercheur
Luc Pellerin
Directeur d’unité
U1313 IRMETIST (Inserm, Université de Poitiers, CHU Poitiers)
E-mail : yhp.cryyreva@havi-cbvgvref.se
Téléphone sur demande
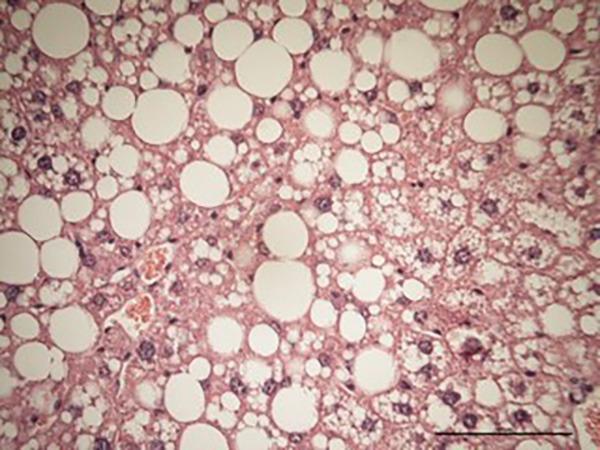
Cellules du foie envahies par des gouttelettes lipidiques (en blanc) provenant d’un animal sous régime riche en sucres et en graisses. © Institut Universitaire de Pathologie de l’Université de Lausanne.
La stéatose hépatique non alcoolique touche environ 200 000 personnes en France et se caractérise par une accumulation de graisses dans le foie pouvant conduire à une inflammation puis à la cirrhose. Pour la première fois, des travaux de recherche menés par des chercheurs et chercheuses de l’Inserm, de l’université de Poitiers, du King’s College à Londres et de l’université de Lausanne, suggèrent que les personnes atteintes par cette maladie causée par une consommation excessive de sucre et de graisse pourraient aussi présenter un risque accru de développer des troubles neurologiques graves tels que la démence. Les résultats sont publiés dans la revue Journal of Hepatology.
La stéatose hépatique non alcoolique, aussi appelée « maladie du foie gras », est de plus en plus fréquente dans les sociétés touchées par l’obésité et la sédentarité. Jusqu’à 80 % des personnes souffrant d’obésité morbide seraient concernées.
Plusieurs travaux ont signalé les effets négatifs d’un régime alimentaire déséquilibré et de l’obésité sur la fonction cérébrale, mais cette nouvelle étude est la première à établir une association entre stéatose hépatique non alcoolique et problèmes neurologiques dans des modèles animaux, et à identifier une cible thérapeutique potentielle.
Les scientifiques de l’Inserm, de l’université de Poitiers, de l’Institut d’Hépatologie Robert Williams du King’s College et de l’université de Lausanne ont notamment découvert que l’accumulation de graisse dans le foie entraîne une diminution de l’oxygène dans le cerveau et une inflammation des tissus cérébraux – deux phénomènes associés à une augmentation du risque de maladies neurologiques graves comme par exemple la démence.
Deux régimes alimentaires, des effets différents
Dans le détail, les travaux ont consisté à donner deux régimes alimentaires différents à des souris. La moitié des animaux ont suivi un régime dont l’apport calorique ne contenait pas plus de 10 % de matières grasses, tandis que l’autre moitié avait un apport calorique de 55 % de matières grasses (pour ressembler à un régime composé d’aliments transformés et de boissons sucrées).
Après 16 semaines, les chercheurs ont effectué une série de tests pour comparer les effets de ces deux régimes sur l’organisme, et plus particulièrement sur le foie et le cerveau. Ils ont constaté que toutes les souris consommant les niveaux les plus élevés de graisses étaient considérées comme obèses et développaient une stéatose hépatique non alcoolique ainsi qu’une résistance à l’insuline. Par ailleurs, les scientifiques ont aussi observé chez ces animaux un dysfonctionnement cérébral marqué, qui se traduisait par des troubles du comportement.
L’étude a également montré que le cerveau des souris atteintes de stéatose hépatique non alcoolique présentait des niveaux d’oxygène plus faibles. Selon les scientifiques, deux hypothèses pourraient expliquer ce phénomène : la maladie réduirait le nombre et le diamètre des vaisseaux sanguins cérébraux, qui apporteraient ainsi moins d’oxygène aux tissus. Des cellules spécifiques pourraient aussi consommer davantage d’oxygène à cause de l’inflammation détectée dans le cerveau. Ces souris étaient également plus anxieuses et présentaient des signes de dépression.
« Il est très inquiétant de constater l’effet que l’accumulation de graisses dans le foie peut avoir sur le cerveau, en particulier parce que cette maladie est souvent bénigne au départ et qu’elle peut exister silencieusement pendant de nombreuses années sans que les gens en soient conscients », a déclaré Anna Hadjihambi, première auteure de l’étude et maître de conférences honoraire au King’s College de Londres.
Une protéine cible pour protéger le foie et le cerveau
Pour trouver des solutions permettant de contrer les effets délétères de la pathologie sur le cerveau, les scientifiques ont dans un second temps élevé des souris présentant des niveaux plus faibles d’une protéine connue sous le nom de Monocarboxylate Transporter 1 (MCT1). Celle-ci est spécialisée dans le transport de substrats énergétiques utilisés par diverses cellules pour leur fonctionnement normal. Aux yeux des chercheurs, cette protéine présentait un intérêt particulier en raison de sa distribution dans différents organes impliqués dans la balance énergétique de l’organisme (dont le foie et le cerveau).
Lorsque ces souris ont été soumises à un régime riche en graisses et en sucres, identique à celui de l’expérience initiale, elles n’ont pas présenté d’accumulation de graisses dans le foie ni de signe de dysfonctionnement cérébral.
« L’identification de MCT1 comme élément clé dans le développement de la stéatose hépatique non alcoolique et du dysfonctionnement cérébral qui lui est associé ouvre des perspectives intéressantes », précise Luc Pellerin, dernier auteur de l’étude.
« Elle met en évidence les mécanismes potentiels en jeu dans l’axe foie-cerveau et indique une cible thérapeutique possible. »
Ces travaux de recherche soulignent donc que la réduction de la quantité de sucre et de graisse dans notre alimentation n’est pas seulement importante pour lutter contre l’obésité, mais elle permettrait aussi de protéger le foie afin de préserver la santé du cerveau et de minimiser le risque de développer des maladies comme la dépression et la démence au cours du vieillissement.
Luc Pellerin
Directeur d’unité
U1313 IRMETIST (Inserm, Université de Poitiers, CHU Poitiers)
E-mail : yhp.cryyreva@havi-cbvgvref.se
Téléphone sur demande
Partial MCT1 invalidation protects against diet-induced non-alcoholic fatty liver disease and the associated brain dysfunction
Anna Hadjihambi1, 2, 3 ,Christos Konstantinou2, 3, Jan Klohs4, 5, Katia Monsorno1, Adrien Le Guennec6, Chris Donnelly1, 7, Jane Cox2, 3, Anjali Kusumbe8, Patrick S Hosford9, Ugo Soffientini2, 3, Salvatore Lecca10, Manuel Mameli10, 11, Rajiv Jalan12, Rosa Chiara Paolicelli1,Luc Pellerin1, 13
1 Department of Biomedical Sciences, University of Lausanne, Lausanne, Switzerland
2 The Roger Williams Institute of Hepatology London, Foundation for Liver Research, London, UK
3 Faculty of Life Sciences and Medicine, King’s College London
4 Institute for Biomedical Engineering, University of Zurich and ETH Zurich, Zurich, Switzerland
5 Neuroscience Centre Zurich, University of Zurich and ETH Zurich, Zurich, Switzerland
6 NMR Facility, Guy’s Campus, King’s College London
7 Institute of Sports Science, University of Lausanne, Lausanne, Switzerland
8 Tissue and Tumor Microenvironments Group, MRC Human Immunology Unit, MRC Weatherall Institute of Molecular Medicine, University of Oxford, Oxford, UK
9 Centre for Cardiovascular and Metabolic Neuroscience, Neuroscience, Physiology and Pharmacology, University College London, London, UK.
10 The Department of Fundamental Neuroscience, University of Lausanne, Lausanne, Switzerland
11 Inserm UMR-S 839, 75005, Paris, France
12 Institute for Liver and Digestive Health, Division of Medicine, UCL Medical School, Royal Free Hospital, University College London, London, UK.
13 U1313 IRMETIST, Université de Poitiers, CHU Poitiers, Inserm, Poitiers, France
Journal of Hepatology, novembre 2022
DOI : 10.1016/j.jhep.2022.08.008