Comment le défaut d’un acide gras explique la maladie de Crohn ?
Deux équipes de recherche de l’Inserm viennent de montrer qu’un défaut de production par l’intestin d’un « messager » lipidique, était associé à la maladie de Crohn, une maladie inflammatoire chronique de l’intestin (MICI) fréquente et très invalidante. Ce messager, dérivé d’un acide gras essentiel, régule la perméabilité de la barrière intestinale et pourrait ainsi devenir une cible de choix dans la prise en charge des MICI. Ces travaux éclairent aussi d’un jour nouveau le rôle des cellules gliales entériques. A l’égal de leurs homologues du système nerveux central, trop longtemps considérés comme jouant un « second rôle », les cellules gliales de l’intestin commencent à dévoiler leur « jeu » en réalité indispensable à l’homéostasie intestinale. Le détail de ces travaux est publié dans Gastroenterology.
Le système nerveux entérique joue un rôle central dans le contrôle de l’homéostasie des fonctions digestives telles que la motricité ou encore le contrôle des fonctions de la barrière épithéliale intestinale. Ce système nerveux intégratif, situé tout le long du tube digestif, est constitué de neurones et de cellules gliales. Le rôle des cellules gliales entériques reste encore largement à découvrir. Un nombre croissant d’études montrent qu’elles régulent, de manière analogue aux astrocytes du cerveau, les fonctions des neurones entériques mais aussi de la barrière épithéliale intestinale telles que la prolifération des cellules épithéliales, leur migration, la perméabilité (paracellulaire et transcellulaire) ainsi que les processus de réparation. Les cellules gliales régulent ces fonctions via la libération de différents gliomédiateurs dont certains dérivés lipidiques des acides gras polyinsaturés (AGPI) n-6.
Par ailleurs, les atteintes des cellules gliales entériques (CGE) dans des pathologies associées à des dysfonctions de la barrière intestinale, restent limitées à la description de modification d’expression de marqueurs gliaux. Ces dysfonctions de la barrière intestinale (augmentation de la perméabilité, défaut de réparation) sont reconnues comme pouvant jouer un rôle clef dans les maladies inflammatoires chroniques de l’intestin (MICI) en participant au déclenchement des rechutes. Réduire ces dysfonctions est aussi un mécanisme d’action probable des biothérapies utilisées dans la prise en charge des MICI.
Dans ce contexte Malvyne Rolli Derkinderen et Michel Neunlist, chercheurs de l’Unité mixte de recherche Inserm-Université de Nantes « Neuropathies du système nerveux entérique et pathologies digestives », et leurs collaborateurs de l’Institut de Recherche en Santé Digestive de Toulouse Purpan, ont cherché dans un premier temps à caractériser la production de médiateurs lipidiques dérivés des n-6 dans les cellules gliales entériques animales et humaines. Ils ont ensuite analysé l’impact des dérivés des AGPI majoritairement produits sur des fonctions de la barrière épithéliale intestinale, et, enfin, ont mis en évidence le défaut de production de l’un d’entre eux chez les patients atteints de maladie de Crohn.
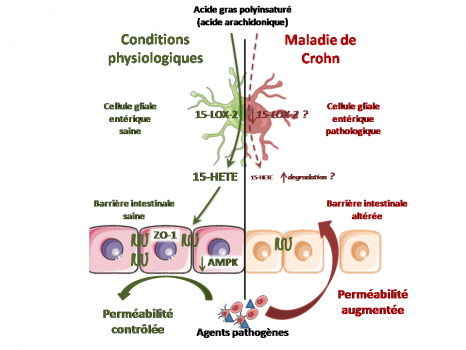
En vert : en situation physiologique, les cellules gliales entériques produisent des dérivés lipidiques dont la 15-HETE qui renforce l’étanchéité de la barrière épithéliale intestinale et empêche le passage de pathogène.
En rouge : au cours de la Maladie de Crohn, il existe un déficit de production gliale de 15-HETE qui conduit à une augmentation de la perméabilité de la barrière et facilite le passage de pathogènes. Ceci contribuerait aux rechutes de la maladie ou à sa sévérité.
Ainsi les chercheurs ont montré que les CGE humaines (et de rat) sont capables de produire des AGPI n-6, et notablement le 15-HETE, synthétisé par la 15-lipoxygenase-2. Ce 15-HETE renforce la barrière épithéliale intestinale en diminuant la perméabilité paracellulaire in vivo et in vitro, en particulier en augmentant l’expression de molécules des jonctions serrées dont la Zonula Occludens-1.
Dans des CGE isolées de patients atteints par la Maladie de Crohn, les chercheurs ont mis en évidence un défaut de production de 15-HETE associé à une perte de la capacité des CGE à contrôler la perméabilité de la barrière épithéliale intestinale.
Ces travaux identifient donc les AGPI n-6 comme source de dérivés aux effets potentiellement bénéfiques sur les fonctions de la barrière épithéliale intestinale dans les MICI. Pour Camille Pochard et Sabrina Coquelorge, les 2 premières auteures, « ces résultats contribuent à la fois à renforcer le rôle des cellules gliales en particulier et du système nerveux entérique en général dans les processus physiopathologiques des MICI et aussi d’identifier de nouvelles cibles d’intérêt thérapeutique».