Le mécanisme de la sénescence – ou vieillissement prématuré des cellules – peut avoir un effet anticancéreux. Ces nouveaux travaux, menés par Hugues de Thé et son équipe (université Paris Diderot/ Inserm/ CNRS/ AP-HP), sont publiés dans Nature Medecine le 12 janvier 2014. Ils révèlent que les traitements ciblés de la leucémie aiguë promyélocytaire, une forme rare de cancer du sang, induisent une cascade d’événements moléculaires qui conduit à la sénescence cellulaire et à la guérison. Ce modèle d’action pourrait être activé dans d’autres types de cancers.
La protéine PML/RARA* est à l’origine de la prolifération des cellules cancéreuses chez les patients atteints de leucémie aiguë promyélocytaire. Les traitements ciblés déjà existants et associant une hormone – l’acide rétinoïque – et un toxique – l’arsenic – entrainent la guérison définitive de la majorité des patients, sans que l’on connaisse précisément leur action sur les cellules cancéreuses. De précédents travaux de l’équipe du Pr. Hugues de Thé ont montré que la combinaison de l’arsenic et de l’acide rétinoïque induit la destruction de la protéine PML/RARA et l’élimination des cellules souches leucémiques. Il restait à comprendre le lien entre ces deux événements.
Ces nouvelles recherches apportent les éléments nécessaires pour comprendre la guérison. Elles démontrent l’implication inattendue d’une cascade d’événements conduisant à la sénescence. L’intérêt du traitement est d’atteindre ce stade ultime de vieillissement des cellules afin de les rendre incapables de se multiplier.
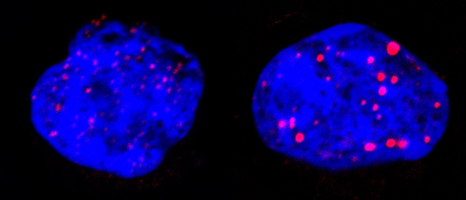
Lors de ce traitement ciblé les chercheurs ont montré que la protéine p53**, arbitre entre mort cellulaire et survie, déclenche la sénescence grâce à l’implication de corps nucléaires PML. Ces structures sphériques sont présentes dans les cellules normales, mais sont désorganisées par PML/RARA dans la leucémie. Le traitement les réorganise (voir illustration ci-dessous), activant p53 et déclenchant la sénescence. Dans cette cascade d’événements (traitement, dégradation de PML/RARA, reformation des corps nucléaires, activation de p53) il suffit qu’un maillon manque pour que tous les effets thérapeutiques soient bloqués.
Cellules leucémiques avant (gauche) et après traitement (droite). Le bleu représente l’ADN du noyau, le rouge les corps nucléaires PML. Ceux-ci sont réorganisés par le traitement PML/RARA.
©Photos transmises par le Pr. Hugues de Thé
C’est ce phénomène qui permet l’élimination des cellules malades et conduit à la guérison totale du patient, par le seul traitement combiné acide rétinoïque/arsenic. L’absence de chimiothérapie permet d’éviter beaucoup d’effets secondaires lourds.
Cette compréhension du mécanisme cellulaire et moléculaire de la guérison de la leucémie aiguë promyélocytaire ouvre des perspectives d’activation de cette même voie PML/p53 dans d’autres types de cancers.
Ces travaux ont été financés par La Ligue contre le cancer, la Fondation ARC pour la recherche sur le cancer et l’European Research Council (ERC).
* A l’origine de cette leucémie aiguë promyélocytaire, la modification de deux gènes RAR et PML qui engendrent le développement de cellules cancéreuses ;
** Le gène codant pour la protéine p53 joue un rôle essentiel dans la prolifération cellulaire à l’état normal et dans le maintien de l’intégrité du génome cellulaire.