Contact Chercheur
Frédérique Bonnet-Brilhault
U1253 Imagerie & Cerveau (Inserm/Université de Tours)
E-mail : serqrevdhr.oevyunhyg@havi-gbhef.se
Téléphone sur demande
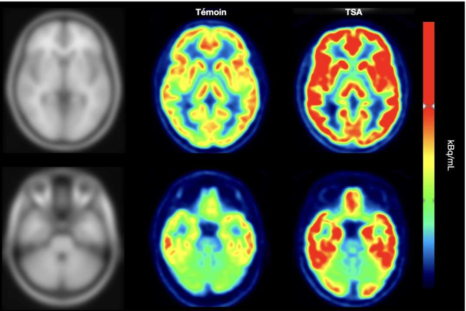
Images montrant l’anatomie cérébrale humaine sur deux plans de coupes axiales obtenue par IRM (partie gauche), puis les images correspondantes en imagerie moléculaire montrant une quantité plus élevée de récepteurs mGluR5 dans le cerveau d’un sujet adulte avec TSA (partie droite) comparativement à un témoin (partie centrale). © Laurent Galineau
Si la compréhension des troubles du spectre de l’autisme (TSA) a grandement progressé au cours des dernières années, les mécanismes moléculaires sous-jacents demeurent assez mal documentés. Plusieurs hypothèses ont été évoquées concernant un possible dysfonctionnement de certains neurotransmetteurs dans le cerveau, mais des études scientifiques rigoureuses manquent encore pour les valider. Dans une nouvelle publication, des chercheurs et chercheuses de l’Inserm et de l’université de Tours, au sein du laboratoire Imagerie & Cerveau, ont montré que des récepteurs particuliers du glutamate, un des neurotransmetteurs les plus importants du système nerveux, sont exprimés en grande quantité dans le cerveau d’adultes avec TSA. Toutefois, cette surexpression des récepteurs ne se retrouve pas à des stades plus précoces du développement. L’étude, promue par le CHU de Tours et publiée dans Molecular Psychiatry, ouvre la voie à une meilleure compréhension des TSA pour permettre d’affiner les recherches thérapeutiques.
Les troubles du spectre de l’autisme (TSA) résultent de particularités du neuro-développement et concernent environ 700 000 personnes en France. Ce terme regroupe des réalités cliniques très hétérogènes et les besoins spécifiques de chaque personne sont ainsi très variés. Le développement de traitements ciblant de façon spécifique les troubles sévères liés à l’autisme a longtemps été freiné en raison d’une connaissance parcellaire des mécanismes moléculaires et génétiques sous-jacents.
Parmi les pistes avancées pour expliquer le développement du TSA, figure celle d’un dysfonctionnement du glutamate – le principal neurotransmetteur excitateur du système nerveux central. Des études ont récemment suggéré que des récepteurs du glutamate appelés « mGluR5 » (voir encadré) seraient exprimés en quantité augmentée dans certaines régions du cerveau chez les personnes concernées par les TSA.
mGluR5 est un récepteur abondamment exprimé au niveau du système nerveux central et en particulier au niveau du cortex cérébral, de l’hippocampe, du septum latéral, du striatum dorsal et du noyau accumbens, autant de régions cérébrales impliquées dans la cognition, le contrôle moteur et l’émotivité.
mGluR5 appartient à un sous-groupe de huit récepteurs qui sont activés par le glutamate, le principal neurotransmetteur excitateur du système nerveux central.
L’intervention pharmacologique sur ces récepteurs, et en particulier le blocage de mGluR5, est déjà en cours d’évaluation pour divers troubles comme l’anxiété, la dépression, la schizophrénie, la maladie de Parkinson, ou encore les addictions.
Mécanisme de compensation
Afin d’aller plus loin dans la compréhension des mécanismes moléculaires du TSA, l’équipe menée par Frédérique Bonnet-Brilhault au sein du laboratoire Imagerie & Cerveau (unité 1253 Inserm/Université de Tours) a cherché à mieux caractériser les dysfonctionnements du glutamate dans le cerveau d’adultes avec TSA.
Dans un premier temps, ils ont quantifié les niveaux de glutamate dans le cortex cingulaire de 12 adultes avec TSA et de 14 adultes sans TSA (participants « témoins »), en utilisant plusieurs approches méthodologiques. Dans un second temps, ils se sont intéressés à l’expression des récepteurs mGluR5 dans le cerveau des participants.
Les scientifiques ont ainsi observé que les niveaux de glutamate étaient très hétérogènes chez les adultes avec TSA. En revanche, ils ont constaté que la quantité de récepteurs mGluR5 exprimés était particulièrement élevée dans le cerveau de tous ces individus, comparativement aux témoins.
Ensuite, pour mieux comprendre comment la quantité de mGluR5 varie à différents stades du développement, l’équipe a aussi quantifié ces récepteurs dans le cerveau de jeunes rats – des modèles animaux de TSA et des animaux « témoins ».
Les analyses montrent que les quantités de mGluR5 des « rats TSA » et des « rats témoins » ne différaient pas pendant l’enfance. Cependant, à l’adolescence, ces récepteurs étaient présents en quantité plus importante dans certaines régions du cerveau des « rats TSA ».
Le fait que les récepteurs mGluR5 soient exprimés en grande quantité chez les adultes TSA qui participaient à l’étude, mais pas aux stades les plus précoces du développement dans les modèles animaux, suggère que la surexpression de ces récepteurs ne serait pas une cause de ce trouble, mais plutôt une conséquence qui apparaîtrait progressivement au cours de la vie.
« Nos résultats suggèrent que les changements dans la quantité des récepteurs mGluR5 exprimés au cours du développement pourraient être un mécanisme de compensation en réponse à des dysfonctionnements précoces des systèmes de communication du cerveau, plutôt qu’un élément primaire à l’origine du développement des TSA », explique Frédérique Bonnet-Brilhault.
À l’heure où la recherche chez les adultes TSA est une réelle priorité, ces travaux pointent la nécessaire compréhension de la trajectoire de développement de chaque individu avec TSA pour distinguer les causes des mécanismes d’adaptation.
Le point sur les TSA
L’autisme « typique », décrit par le pédopsychiatre Leo Kanner en 1943, est aujourd’hui intégré dans un ensemble plus vaste, celui des « troubles du spectre de l’autisme (TSA) ». Ce terme permet de rendre mieux compte de la diversité des situations. Ces troubles se caractérisent par :
Les TSA peuvent également être associés à des comorbidités : troubles anxieux, problèmes de sommeil, déficits de la fonction motrice, épilepsie…
Au sein de cette grande diversité clinique, il est important de relever les « atouts » ou « talents » qui peuvent découler de ce développement cérébral atypique. Le développement de thérapeutiques doit donc cibler ce qui correspond aux plaintes des personnes tout en préservant leurs particularités.
Frédérique Bonnet-Brilhault
U1253 Imagerie & Cerveau (Inserm/Université de Tours)
E-mail : serqrevdhr.oevyunhyg@havi-gbhef.se
Téléphone sur demande
Glutamatergic Synapse in Autism: A complex story for a complex disorder
Molecular Psychiatry, Novembre 2022
DOI: https://doi.org/10.1038/s41380-022-01860-9
Laurent Galineau1,6, Nicolas Arlicot1,4,6, Anne-Claire Dupont1,4,5, Frederic Briend1,3, Emmanuelle Houy-Durand1,3, Clovis Tauber1, Marie Gomot1,3, Valérie Gissot2, Laurent Barantin1, Antoine Lefevre1, Johnny Vercouillie1, Catherine Roussel1,3, Sylvie Roux1,3, Lydie Nadal1, Sylvie Mavel1, Frédéric Laumonnier1, Catherine Belzung1, Sylvie Chalon1, Patrick Emond1, Maria-Joao Santiago-Ribeiro1,5, Frédérique Bonnet-Brilhault1,3
1 UMR 1253, iBrain, Université de Tours, Inserm, Tours, France
2 Inserm CIC 1415, CHRU de Tours, Tours, France
3 Excellence Center for Autism and Neurodevelopmental Disorders, CHRU de Tours, Tours, France
4 Unité de Radiopharmacie, CHRU de Tours, Tours, France
5 Service de Médecine Nucléaire, CHRU de Tours, Tours, France
6 participated equally to this work