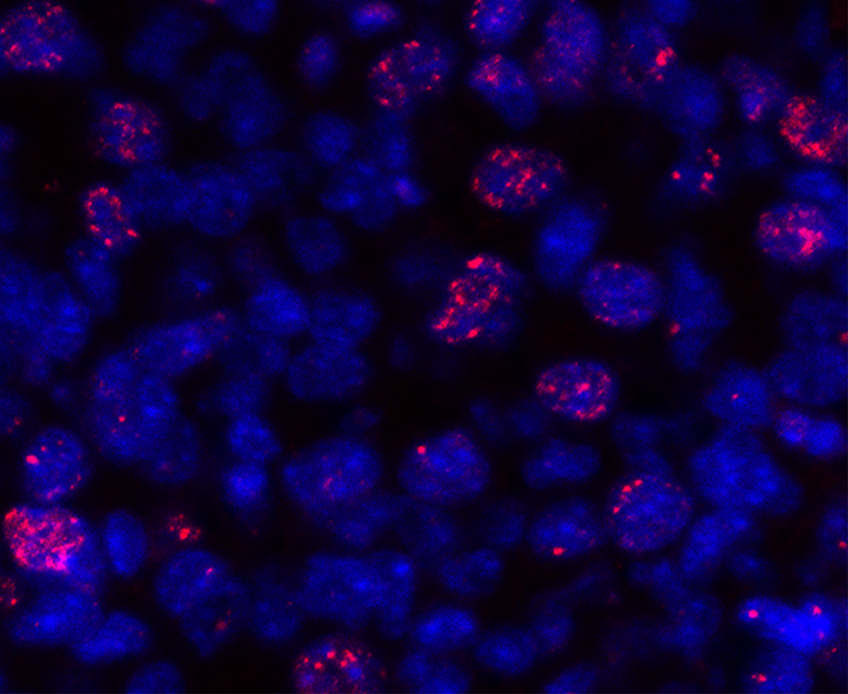
Effet convergent du cisplatine et du KW6002 sur les cassures double brin de l’ADN dans des cellules tumorales pulmonaires. Le bleu correspond aux noyaux des cellules et le rouge à une protéine qui marque les dommages à l’ADN. © Dewaeles et al.
Le cisplatine est une chimiothérapie indiquée pour lutter contre les tumeurs dans de nombreux cancers. Elle s’accompagne toutefois d’effets secondaires importants, en particulier une toxicité au niveau des reins qui peut entraîner une insuffisance rénale aiguë. Par ailleurs, les patients traités par le cisplatine rapportent aussi souvent souffrir de douleurs neuropathiques importantes. Des scientifiques de l’Inserm, de l’université et du CHU de Lille, du CNRS et de l’Institut Pasteur de Lille, au sein des laboratoires CANTHER[1] et Lille Neuroscience & Cognition, en collaboration avec des chercheurs de l’université d’état du Michigan (États-Unis) ont identifié un médicament qui pourrait changer la donne pour les patients. Déjà autorisée contre la maladie de Parkinson, cette molécule appelée istradefylline pourrait non seulement réduire les effets délétères de la chimiothérapie mais aussi améliorer ses propriétés anti-tumorales. Ces résultats devront maintenant être consolidés dans le cadre d’un essai clinique. L’étude est publiée dans The Journal of Clinical Investigation.
Le cisplatine est une chimiothérapie utilisée dans le traitement de plusieurs cancers, dont le cancer des poumons, des ovaires ou encore des testicules. Si son efficacité anti-tumorale est avérée, cette thérapie s’accompagne également d’effets secondaires, notamment de douleurs intenses (neuropathie périphérique) et de dommages pour les reins, qui peuvent aller jusqu’à une insuffisance rénale aiguë dans un tiers des cas. A l’heure actuelle, il n’existe pas de solution spécifique pour limiter ces problèmes qui touchent de nombreux patients exposés au cisplatine.
Afin d’améliorer leur prise en charge, le développement de nouvelles stratégies thérapeutiques constitue donc un axe de recherche majeur pour de nombreux scientifiques.
C’est le cas des équipes menées par Christelle Cauffiez, David Blum et Geoffroy Laumet des laboratoires CANTHER (Inserm/ /CNRS/Université de Lille/CHU de Lille), Lille Neuroscience & Cognition (Inserm/Université de Lille/CHU de Lille) et du Département de Physiologie de l’Université d’État du Michigan qui ont identifié une molécule capable de réduire les effets secondaires du cisplatine, tout en préservant, voire en augmentant ses propriétés anti-tumorales.
Un médicament pour la maladie de Parkinson
Les scientifiques se sont intéressés à un médicament appelé « istradefylline » qui a déjà été approuvé aux États-Unis et au Japon pour le traitement de la maladie de Parkinson. Ce médicament fonctionne en bloquant des récepteurs à la surface de nos cellules, les récepteurs de l’adénosine.
L’équipe de David Blum, qui travaille sur les pathologies neurodégénératives s’était déjà aperçue que ces récepteurs sont en quantité augmentée dans le cerveau des patients en contexte pathologique et que ce phénomène est impliqué dans le développement de ces maladies. Or, une augmentation similaire des récepteurs de l’adénosine a également été observée par l’équipe de Christelle Cauffiez au niveau rénal lorsque l’organisme est exposé au cisplatine.
Face à ce constat, les scientifiques ont donc décidé de travailler ensemble pour tester les effets de l’istradefylline afin de déterminer si le fait de bloquer ces récepteurs permet de réduire les effets délétères du cisplatine.
Des résultats à confirmer dans un essai clinique
Leurs expériences, menées à partir de modèles animaux et cellulaires ont effectivement suggéré le rôle bénéfique de l’istradefylline. En effet, chez les souris exposées à cette chimiothérapie, la molécule agit en réduisant non seulement les dommages causés aux cellules rénales mais également la douleur induite par le cisplatine.
En outre, la capacité du cisplatine à réduire la croissance tumorale était augmentée chez les animaux qui recevaient de l’istradefylline, ce qui a ensuite été confirmé dans les modèles cellulaires.
Avant d’envisager la généralisation de cette approche thérapeutique aux patients atteints de cancers, ces résultats devront d’abord être consolidés en organisant un essai clinique rigoureux. Néanmoins, le fait que l’istradefylline soit déjà utilisée chez l’humain pour traiter une autre pathologie constitue d’ores et déjà une perspective intéressante.
« De fait, nous disposons déjà de nombreuses données issues d’essais cliniques qui montrent que cette molécule est sûre. S’il est nécessaire de mener une étude clinique afin de tester son efficacité pour réduire les effets secondaires de la chimiothérapie, la possibilité d’un repositionnement thérapeutique est une perspective prometteuse pour améliorer la prise en charge des patients à court terme », soulignent les chercheurs.
[1] Laboratoire Hétérogénéité, plasticité et résistance aux thérapies des cancers (CANTHER)
Ces contenus pourraient aussi vous intéresser :


