Contact Chercheur
Elisabeth Traiffort
U1195 « Maladies et hormones du système nerveux » (Inserm/Université Paris-Saclay)
E-mail : ryvfnorgu.genvssbeg@vafrez.se
Téléphone sur demande
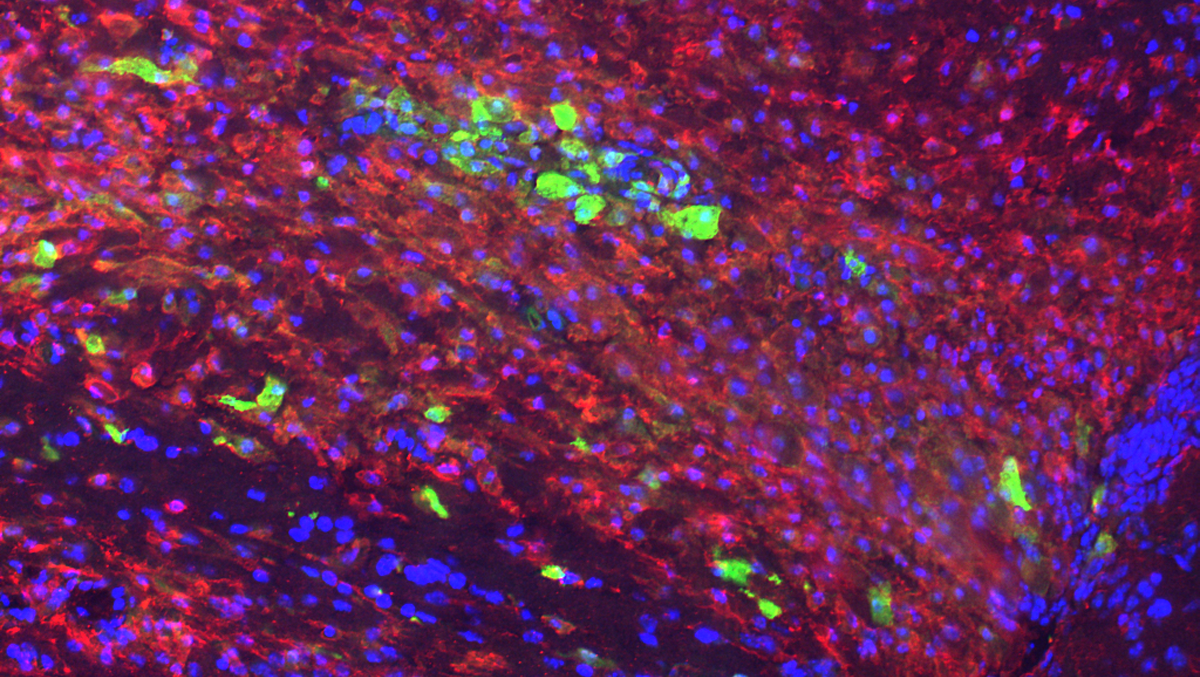
L’image montre la région cérébrale où l’on induit classiquement la démyélinisation. Les cellules rouges correspondent à l’ensemble des cellules microgliales ayant des propriétés inflammatoires quand la démyélinisation vient de se produire. Si le processus de régénération spontanée de la myéline est efficace, leur caractère inflammatoire s’atténue ensuite au profit d’un caractère anti-inflammatoire et pro-régénératif. Les cellules vertes sont une sous-population de ces cellules microgliales qui deviennent anti-inflammatoires. © Zahaf et al.
La sclérose en plaques, maladie auto-immune pour laquelle il n’existe pas encore de traitement curatif, touche trois femmes pour un homme. Face à ce constat, des scientifiques s’intéressent au rôle des hormones sexuelles pour mieux comprendre les différences entre hommes et femmes face à la maladie ainsi que sa progression. Une équipe de recherche menée par la chercheuse Inserm Elisabeth Traiffort au sein de l’unité U1195 « Maladies et hormones du système nerveux » (Inserm/Université Paris-Saclay) vient de montrer que même si les hormones masculines – les androgènes – sont présentes à des taux très faibles chez les femmes, leur présence est nécessaire pour régénérer la gaine de myéline qui est détruite dans la sclérose en plaques. Ces résultats sont publiés dans la revue Nature Communications.
La sclérose en plaques est une maladie auto-immune. Sous sa forme la plus fréquemment rencontrée, dite récurrente-rémittente[1] qui représente 85% des cas, elle se traduit par des poussées inflammatoires au cours desquelles les cellules immunitaires des patients s’attaquent à la myéline du système nerveux central et la détruisent (voir encadré). Ce phénomène entraine des lésions qui provoquent des troubles notamment moteurs, sensitifs ou visuels.
Ces symptômes sont réversibles au début de la maladie, grâce à la réparation spontanée de la myéline détruite. Cependant, avec le temps, les symptômes deviennent peu à peu irréversibles, ce qui reflète l’échec du processus de réparation et fait entrer les patients dans la phase progressive de la maladie. Si les traitements actuels permettent de réduire la fréquence et la sévérité des poussées inflammatoires améliorant donc la qualité de vie des patients, ils restent néanmoins inefficaces contre la progression de la maladie.
Qu’est-ce que la myéline ? Un axone est le prolongement unique par lequel un neurone communique avec sa cellule cible. La myéline est une membrane biologique qui s’enroule autour des axones pour constituer une gaine. La gaine de myéline sert à isoler et à protéger les fibres nerveuses. Elle joue aussi un rôle d’accélérateur de la vitesse de propagation des messages nerveux transportant l’information le long de l’axone. La démyélinisation consiste en la destruction de la gaine de myéline suite à l’attaque du système nerveux.
La recherche actuelle vise ainsi à mieux appréhender les mécanismes de la maladie et à développer de nouvelles pistes thérapeutiques qui permettraient d’éviter l’entrée des patients dans la phase progressive, notamment en favorisant la régénération de la myéline. La chercheuse Inserm Elisabeth Traiffort et son équipe au sein de l’unité « Maladies et hormones du système nerveux » (Inserm/Université Paris-Saclay) s’attèlent par exemple à mieux comprendre les différences entre les femmes et les hommes face à la sclérose en plaques, afin de déterminer s’il pourrait être bénéfique, voire nécessaire, d’adapter la prise en charge thérapeutique en fonction du sexe des patients. Rappelons que la maladie est essentiellement féminine, puisque trois patients sur quatre sont des femmes.
Investiguer le rôle des androgènes chez les femmes
Si l’environnement hormonal des hommes et des femmes est très différent, il ne peut néanmoins être restreint à l’existence de taux élevés d’androgènes chez les hommes et de taux fluctuants d’estrogènes et de progestérone chez les femmes. Ainsi, on sait que les hommes produisent eux-aussi des estrogènes, en particulier dans le cerveau où l’on trouve l’enzyme permettant de convertir les androgènes en estrogènes, tandis que les femmes produisent elles de petites quantités d’androgènes. C’est sur ce dernier aspect que la chercheuse Inserm Elisabeth Traiffort et ses collègues se sont focalisés dans leur dernière étude.
Des travaux avaient déjà montré que les androgènes protègent les neurones dans le système nerveux central des hommes atteints de formes récurrentes-rémittentes de sclérose en plaques et induisent la régénération des gaines de myéline détruites chez le mâle, dans des modèles animaux de la maladie. Mais quel est le rôle des petites quantités d’androgènes que l’on retrouve aussi dans le système nerveux central des femmes ? Les androgènes, présents à des taux bien plus faibles que chez les hommes, peuvent-ils aussi avoir un impact sur la progression de la maladie chez les patientes ?
Les scientifiques ont travaillé avec des modèles animaux de la maladie mais également à partir de tissus de patients issus de banques de dons d’organes. Ils ont d’abord montré que dans les régions où la myéline est détruite, le récepteur AR qui permet aux androgènes de transmettre leur signal est fortement exprimé dans le tissu nerveux des femmes atteintes de sclérose en plaques, comme dans celui de souris femelles utilisées comme modèles de la maladie. Cette observation suggérait l’existence d’un rôle essentiel des androgènes au niveau du tissu démyélinisé des femmes atteintes.
En accord avec cette hypothèse, les scientifiques ont montré que même s’ils ne sont présents qu’en faible quantité chez les souris femelles, les androgènes ont bien une action favorisant une régénération optimale de la myéline détruite. En effet, lorsque les signaux transmis par les androgènes sont totalement absents, cette régénération est fortement réduite.
Enfin, d’autres observations menées chez l’animal et dans les tissus humains suggèrent que ces mêmes androgènes ont aussi des effets anti-inflammatoires majeurs dans le tissu nerveux démyélinisé des femelles contrairement à ce qui est observé chez les mâles. Les effets bénéfiques des androgènes chez les femmes atteintes de sclérose en plaques pourraient donc également être liés à la diminution du niveau d’inflammation locale, dans les zones où la myéline est détruite. Ce résultat est intéressant si l’on considère l’hypothèse actuelle selon laquelle la progression de la maladie pourrait être étroitement associée aux cellules inflammatoires résidant dans le tissu nerveux.
« Alors que les faibles taux d’androgènes détectés chez les femmes pouvaient laisser présager un rôle mineur pour ces hormones dans la maladie, nous montrons que ce n’est pas le cas. Nos données suggèrent l’utilisation de doses appropriées d’androgènes chez les femmes atteintes de sclérose en plaques et la nécessité de prendre en considération le sexe du patient dans l’approche thérapeutique de cette pathologie et vraisemblablement des autres pathologies mettant en jeu une destruction de la myéline du système nerveux central », conclut Elisabeth Traiffort.
Ces travaux ont été réalisés avec le soutien de la Fondation ARSEP.
[1] Il existe deux modes évolutifs de la maladie. La forme récurrente-rémittente est la plus fréquente. Elle représente 85% des cas au début de la maladie. Son évolution se fait sous forme de poussées, avec l’apparition de symptômes en quelques heures ou en quelques jours, souvent associés à une fatigue extrême et inhabituelle évocatrice du diagnostic. Puis, les symptômes disparaissent totalement ou partiellement en quelques semaines. La forme progressive dite ‘primaire’ ne représente que 15% des cas. Elle correspond à une aggravation lente et continue des symptômes neurologiques, sans poussées et sans rémission.
Elisabeth Traiffort
U1195 « Maladies et hormones du système nerveux » (Inserm/Université Paris-Saclay)
E-mail : ryvfnorgu.genvssbeg@vafrez.se
Téléphone sur demande
Androgens show sex-dependent differences in myelination in immune and non-immune murine models of CNS demyelination
Amina Zahaf1, Abdelmoumen Kassoussi1, Tom Hutteau-Hamel2, Amine Mellouk2, Corentine Marie3, Lida Zoupi4, Foteini Tsouki4, Claudia Mattern5, Pierre Bobé2, Michael Schumacher1, Anna Williams4, Carlos Parras3, Elisabeth Traiffort1,*
1 Université Paris-Saclay, Inserm, Maladies et hormones du système nerveux, 94276, Le Kremlin-Bicêtre, France.
2 Université Paris-Saclay, Inserm, Inflammation microbiome immunosurveillance, 92290, Châtenay-Malabry, France.
3 Paris Brain Institute, Sorbonne University, U1127 Inserm, UMR 7225 CNRS, Hôpital Pitié- Salpêtrière, Paris, France.
4 Centre for Regenerative Medicine, Institute for Regeneration and Repair, The University of Edinburgh, Edinburgh BioQuarter, Edinburgh, UK
5 M et P Pharma AG, Emmetten, Switzerland.
Nature communications, mars 2023
DOI:10.1038/s41467-023-36846-w