Des ARN particuliers de petites tailles sont responsables du contrôle de l’expression de la gonadolibérine ou GnRH (Gonadotropin Releasing Hormone), une neurohormone qui pilote la maturation sexuelle, l’apparition de la puberté et la fertilité à l’âge adulte. C’est ce que vient de démontrer l’équipe « Développement et plasticité du cerveau neuroendocrine » dirigée par Vincent Prévot, Directeur de recherche Inserm (Centre Jean-Pierre Aubert, Lille). L’intervention des micro-ARNs, transcrits de l’ADN, s’opère autour de la naissance, et marque une étape clé du développement postnatal. Une défaillance de l’action de ces micro-ARNs entraine une perturbation, voire l’arrêt total, de la production de GnRH par les neurones de l’hypothalamus qui la synthétise, et ainsi une infertilité. Dans les cas les plus graves, une stérilité peut intervenir. Le détail de ces travaux sur la souris est publié dans la revue Nature Neuroscience datée du 2 mai 2016.
(c) Inserm/Andrea Messina
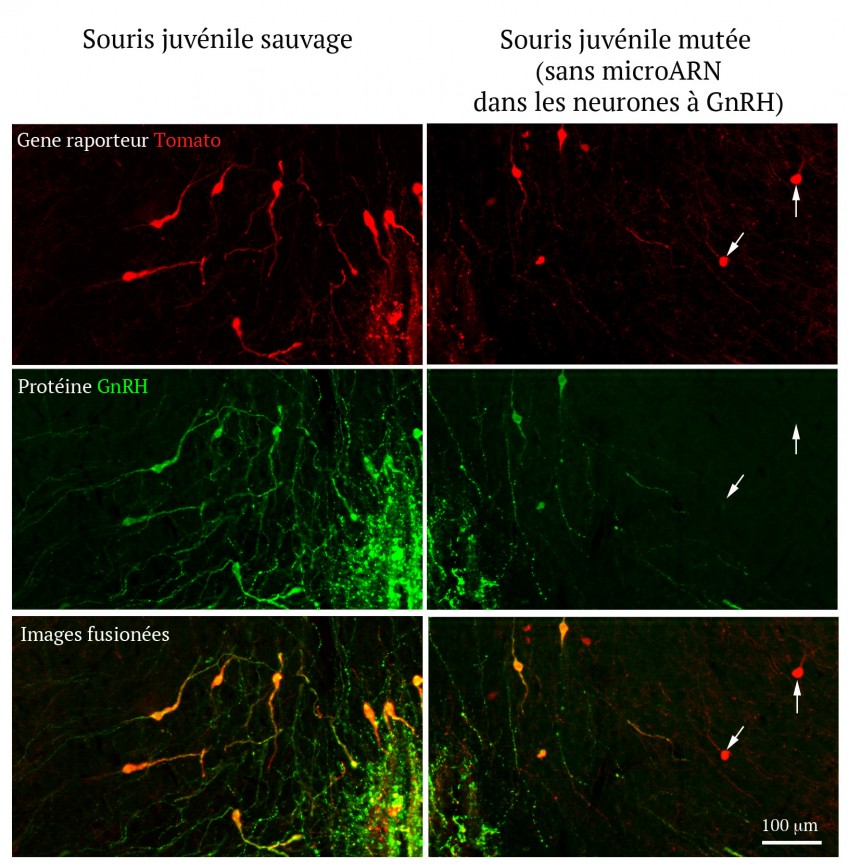
Illustration montrant l’expression de la neurohormone GnRH (vert) dans les neurones hypothalamiques qui la produisent chez des souris dont les neurones à GnRH ont été marqués génétiquement par le gène codant la Tomato (gène qui produit une protéine fluorescente rouge).
La fonction de reproduction est déterminée par des événements qui prennent place dans le cerveau. La gamétogenèse (la production de spermatozoïdes et d’ovocytes) et les secrétions hormonales des ovaires et des testicules dépendent étroitement de l’hypophyse, une petite glande située sous le cerveau auquel elle est reliée par un réseau capillaire. Cette dernière est elle-même sous le contrôle du « chef d’orchestre » des glandes situé à la base du cerveau, l’hypothalamus. Au cours du développement postnatal, l’activation d’une poignée de neurones très spécialisés (les neurones à GnRH) de l’hypothalamus entraîne la synthèse d’une hormone, la gonadolibérine ou GnRH (Gonadotropin Releasing Hormone) et ce processus conduit à l’apparition de la puberté.
Cette étape, appelée « mini-puberté » constitue la première activation de l’axe reproducteur par le cerveau. Elle survient entre le premier et le troisième mois de vie chez le nourrisson et conditionne le bon déroulement de la maturation sexuelle*. Au moment de la puberté, la GnRH stimule la synthèse par l’hypophyse d’autres hormones, qui à leur tour vont passer dans le sang pour promouvoir la croissance des gonades (ovaires, testicules), puis pour assurer la fonction reproductive.
L’apparition de la puberté constitue encore l’une des plus grandes énigmes scientifiques du XXIième siècle. Ces 30 dernières années, la découverte de mutations dans différentes parties du génome de patients souffrant de trouble de la puberté a permis d’identifier quelques gènes impliqués dans ce processus.
Cependant, les médecins et les scientifiques estiment que ces gènes ne sont responsables que d’un tiers des problèmes de puberté rencontrés chez les patients. La découverte de l’implication des micro-ARNs , ouvre d’importantes perspectives médicales pour la prise en charge de ces patients aussi bien d’un point de vue diagnostique que thérapeutique.
Les micro-ARNs sont des ARN non-codants de petites tailles transcrits à partir de notre ADN, Contrairement aux ARN messagers (ARNm), ils ne sont pas traduits en protéines. De ce fait, les micro-ARNs ne font pas partie du « génome codant » et constituent ce que certains appellent l’épi-génome. Les régulations opérées par les micro-ARN sur l’expression des gènes, comme celui de la GnRH, sont donc considérées comme étant des régulations de type « épi-génétiques ».
Les recherches menées par l’équipe de Vincent Prévot chez la souris montrent que la naissance induit un changement radical de l’expression des micro-ARNs dans les neurones à GnRH de l’hypothalamus. Cette modification du profil d’expression des micro-ARNs est indispensable à l’inhibition de l’expression des facteurs de transcription (protéines qui activent ou inhibent l’expression de gènes) qui ont un effet répresseur sur l’expression de la GnRH. Cette inhibition de facteurs inhibiteurs va permettre l’augmentation de la production de GnRH qui est indispensable à la maturation sexuelle infantile et juvénile et à la survenue de la puberté. En effet, en l’absence de micro-ARNs, l’expression des facteurs de transcriptions inhibant l’expression de GnRH augmente et entraine l’extinction de la synthèse de GnRH par le cerveau ce qui conduit à l’arrêt de la maturation sexuelle, l’absence de puberté et à une stérilité totale chez les individus adultes. L’analyse du gène de la GnRH chez l’homme montre que des phénomènes analogues pourraient se produire dans notre propre espèce. Le mécanisme élucidé par cette équipe pourrait donc expliquer l’absence de puberté et l’infertilité chez certains patients pour qui aucune mutation ou polymorphisme (variation dans la séquence d’ADN) n’a été identifiée dans le génome codant.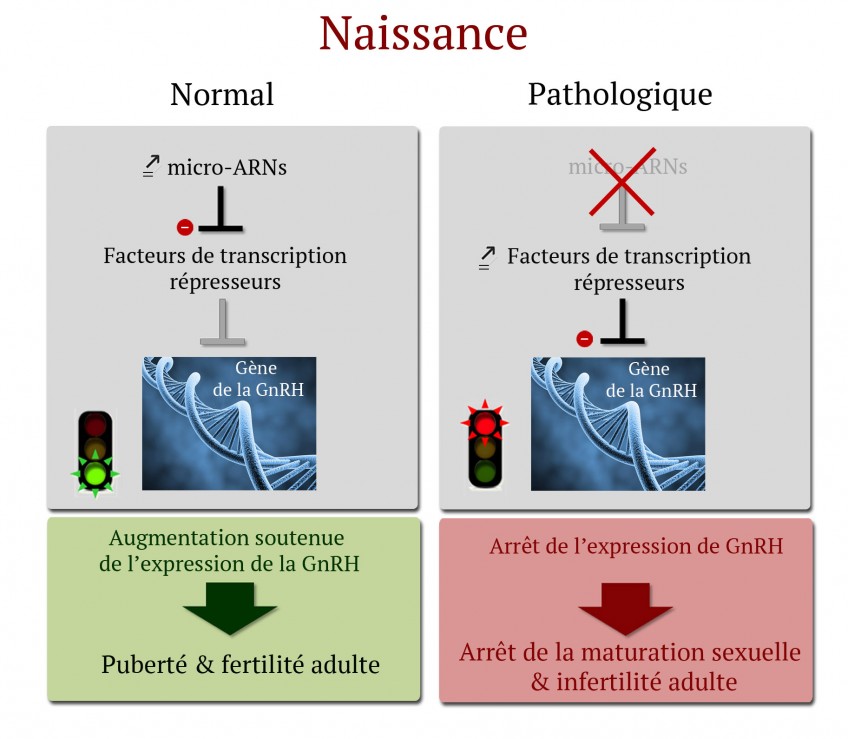
(c) Andrea Messina/Inserm
Sur le plan diagnostique, l’étude réalisée par les chercheurs de l’équipe de Vincent Prevot, à Lille, dévoile l’intérêt d’analyser des portions d’ADN à partir desquelles les micro-ARNs sont transcrits, mais aussi les portions du génome qui vont coder pour leurs sites de liaison sur les gènes cibles. « Les travaux publiés aujourd’hui montrent l’importance d’étudier les séquences du génome qui vont être transcrites en ARNm sur lesquels se lient les micro-ARNs pour réguler leur traduction en protéine », ajoutent les chercheurs.
D’un point de vue thérapeutique, l’interaction des micro-ARNs avec les gènes qu’ils régulent peut être empêchée ou mimée par l’administration de petites molécules analogues, comme l’étude de l’équipe de Vincent Prévot en apporte la preuve de concept.
Cette recherche a reçu le soutien financier de la Fondation pour la Recherche Médicale (FRM).
* Cette mini-puberté est gravement compromise chez les bébés nés prématurés qui ont une plus grande probabilité de développer des troubles de la puberté et une infertilité à l’âge adulte, que les enfants nés à terme.