Des substances chimiques, qui prises isolément, sont sans danger pour l’Homme, peuvent devenir nocives lorsqu’elles sont mélangées. Trois équipes de recherche associant des chercheurs de l’Inserm et du CNRS [1] à Montpellier ont élucidé in vitro un mécanisme moléculaire qui pourrait contribuer à ce phénomène connu sous le nom « d’effet cocktail ». Cette étude est publiée dans la revue Nature Communications.
Nous sommes quotidiennement exposés à de multiples composés exogènes tels que des polluants environnementaux, des médicaments ou des substances provenant de notre alimentation. Certaines de ces molécules, appelées perturbateurs endocriniens, sont fortement suspectées d’interagir inopportunément avec des protéines régulatrices de nos cellules et d’induire de nombreux troubles physiologiques ou métaboliques (cancers, obésité, diabète, …). Par ailleurs, la combinaison de ces molécules dans les mélanges complexes avec lesquels nous sommes généralement en contact pourrait exacerber leur toxicité.
Dans un article à paraitre dans Nature Communications, les chercheurs dévoilent un mécanisme qui pourrait contribuer à cet effet de mélange pour lequel aucune explication rationnelle n’avait pour l’instant été apportée. Ils montrent que certains estrogènes comme l’éthinylestradiol (un des composants actifs des pilules contraceptives) et des pesticides organochlorés tels que le trans-nonachlor, bien que très faiblement actifs par eux-mêmes, ont la capacité de se fixer simultanément à un récepteur situé dans le noyau des cellules et de l’activer de façon synergique.
Les analyses à l’échelle moléculaire indiquent que les deux composés se lient coopérativement au récepteur, c’est-à-dire que la fixation du premier favorise la liaison du second.
Cette coopérativité est due à de fortes interactions au niveau du site de liaison du récepteur, de sorte que le mélange binaire induit un effet toxique à des concentrations largement plus faibles que les molécules individuelles.
Ces résultats obtenus in vitro constituent une preuve de concept qui ouvre la voie à un large champ d’études. Il existe effectivement dans notre environnement environ 150 000 composés dont l’action combinée pourrait avoir des effets inattendus sur la santé humaine au regard de leur innocuité reconnue ou supposée en tant que substances isolées. Si ces travaux sont confirmés in vivo, des retombées importantes sont attendues dans les domaines de la perturbation endocrinienne, la toxicologie et l’évaluation des risques liés à l’utilisation des produits chimiques.
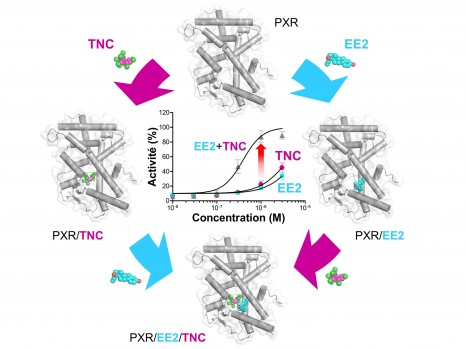
Séparément, l’éthinylestradiol (EE2) et le trans-nonachlor (TNC) se lient seulement à forte concentration au récepteur des xénobiotiques (PXR) et sont des activateurs faibles de ce récepteur. Lorsqu’ils sont utilisés ensemble, les deux composés se stabilisent mutuellement dans la poche de liaison du récepteur. Le « ligand supramoléculaire » ainsi créé possède une affinité augmentée pour PXR, de sorte qu’il est capable d’induire un effet toxique à des doses auxquelles chaque composé est inactif individuellement. © Vanessa Delfosse, William Bourguet
[1] Centre de Biochimie Structurale (CNRS UMR5048 – Inserm U1054), de l’Institut de Recherche en Cancérologie (Inserm U1194) et de l’Institut de Génomique Fonctionnelle (CNRS UMR5203 – Inserm U661)
Ces contenus pourraient aussi vous intéresser :