Cellules basales des voies aériennes d’un modèle animal en culture marquées par la cytokératine 14 en r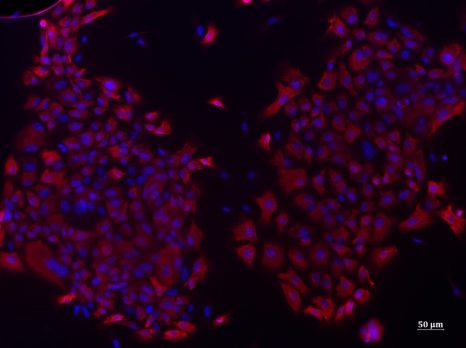
La bronchopneumopathie chronique obstructive (BPCO), troisième cause de mortalité dans le monde en 2019 selon l’OMS, est une maladie respiratoire chronique invalidante dont tous les mécanismes n’ont pas encore été identifiés à ce jour. Dans ce contexte, des chercheuses et des chercheurs de l’Institut Pasteur, d’Université de Paris, du CNRS, de l’Inserm, de l’université de Reims Champagne-Ardenne, du CHU de Reims et de l’Institut Pasteur de Lille, ont montré que la substitution d’un seul nucléotide dans le gène qui code pour le récepteur nicotinique de l’acétylcholine[1] peut entrainer des modifications fonctionnelles des cellules des voies aériennes et conduire à des symptômes similaires à ceux de la BPCO, indépendamment du tabagisme. Les scientifiques ont par ailleurs identifié les mécanismes moléculaires impliqués dans ce phénomène pathologique. Les résultats de cette étude ont été publiés dans le journal Nature Communications, le 4 novembre 2021.
La bronchopneumopathie chronique obstructive (BPCO) est une maladie respiratoire chronique évolutive définie par une obstruction permanente des voies aériennes. Elle touche, dans la population française, 5 à 10% des plus de 45 ans selon Santé publique France. Toux chronique, expectorations et essoufflement s’aggravent au fil des ans et deviennent invalidants.
Des études génétiques précédemment menées chez l’Homme ont associé, dans un premier temps, cette pathologie à des gènes situés sur le chromosome 15, qui codent pour des sous-unités du récepteur nicotinique de l’acétylcholine (nAChR). Dans une nouvelle étude, des scientifiques de l’Institut Pasteur, d’Université de Paris, du CNRS, de l’Inserm, de l’université de Reims Champagne-Ardenne, du CHU de Reims et de l’Institut Pasteur de Lille, ont concentré leur recherche sur la variabilité d’un seul nucléotide (une base Adénine au lieu d’une base Guanine), dans le gène appelé CHRNA5, qui code pour la sous-unité alpha5 du récepteur nAChR, sur le chromosome 15. Cette version du gène est retrouvée dans le génome de 37% de la population européenne. Les scientifiques ont étudié l’effet de cette variation sur les cellules des voies aériennes.
Chez le modèle animal porteur de cette version du gène, l’étude a notamment mis en évidence l’apparition d’un emphysème, c’est-à-dire la destruction de la paroi des alvéoles pulmonaires, un phénomène retrouvé chez les patients atteints de BPCO. « Nous mettons en évidence les conséquences biologiques d’une mutation dans un gène associé à la BPCO » indique Valérian Dormoy, enseignant-chercheur au laboratoire Inserm Pathologies Pulmonaires et Plasticité Cellulaire à l’université de Reims Champagne-Ardenne, et co-dernier auteur de l’étude. Les scientifiques ont associé l’expression de cette version du gène avec une inflammation et un remodelage de l’épithélium des voies aériennes. En effet, les cellules progénitrices basales des voies respiratoires, situées sur la couche profonde de l’épithélium et responsables de son renouvellement, ont un fonctionnement altéré. Ce dysfonctionnement a notamment été observé par les chercheuses et chercheurs au cours du processus de cicatrisation de l’épithélium bronchique.
Les résultats de l’étude ont ensuite pu être confirmés chez l’Homme.
En effet, l’analyse histologique de cellules issues de polypes nasaux prélevés chez 123 patients non-fumeurs du CHU de Reims a également montré une association entre le remodelage de l’épithélium et cette mutation du gène.
« Cette version du gène constituerait un facteur de prédisposition génétique à la maladie, indépendamment du tabagisme. La BPCO survenant à la suite de lésions répétées des tissus des voies aériennes, provoquées par d’autres molécules tels que des polluants atmosphériques », commente Philippe Birembaut, (ancien) chef de service au CHU de Reims (Université de Reims Champagne-Ardenne, Inserm), et co-dernier auteur de l’étude.Par ailleurs, l’analyse in vitro des cellules animales exprimant la version modifiée du récepteur nicotinique, a permis d’identifier les voies de signalisation impliquées. Cette identification pourrait constituer une cible pharmacologique pour le développement d’un futur traitement. « L’un de nos objectifs est de définir les caractéristiques des patients atteints de BPCO et porteurs de cette mutation afin de développer une médecine personnalisée », conclut Uwe Maskos, directeur de l’unité de Neurobiologie intégrative des systèmes cholinergiques à l’Institut Pasteur (Université de Paris, CNRS[2]) et co-dernier auteur de l’étude.
[1] Le récepteur nicotinique de l’acétylcholine est situé dans la membrane des cellules. Il est activé par l’acétylcholine ou la nicotine et contrôle l’entrée de différents ions dans la cellule : calcium, sodium.
[2] Laboratoire « Gènes, synapses et cognition » (CNRS/Institut Pasteur).
Ces contenus pourraient aussi vous intéresser :
An innate contribution of human nicotinic receptor polymorphisms to COPD-like lesions, Nature Communications, 4 novembre 2021
Julie Routhier1, Stéphanie Pons2, Mohamed Lamine Freidja1,8, Véronique Dalstein1,3, Jérôme Cutrona1, Antoine Jonquet1, Nathalie Lalun1, Jean-Claude Mérol1,4, Mark Lathrop5, Jerry A. Stitzel6, Gwenola Kervoaze7, Muriel Pichavant7, Philippe Gosset7, Jean-Marie Tournier1, Philippe Birembaut1,3,9, Valérian Dormoy1,9, Uwe Maskos2,9
1 Université de Reims Champagne-Ardenne, Inserm, P3Cell UMR-S1250 Reims, France.
2 Institut Pasteur, Université de Paris, Integrative Neurobiology of Cholinergic Systems, CNRS UMR 3571 Paris, France.
3 Department of Biopathology, CHU of Reims, Reims, France.
4 Department of Otorhinolaryngology, CHU of Reims, Reims, France.
5 McGill University Genome Center, Montréal, QC, Canada.
6 Institute for Behavioral Genetics, University of Colorado, Boulder, CO, USA.
7 University of Lille, CNRS UMR9017, Inserm U1019, CHU Lille, Institut Pasteur de Lille, CIIL – Center for Infection and Immunity of Lille, Lille, France.
8 Present address: Department of Biochemistry and Microbiology, Faculty of Sciences, University of M’sila, M’sila, Algeria.
9 These authors contributed equally: Philippe Birembaut, Valérian Dormoy, Uwe Maskos.

