Contact Chercheur
Christian Lesterlin
Chercheur Inserm
Laboratoire de microbiologie moléculaire et biochimie structurale (MMSB)
CNRS-UMR5086-Lyon 1
Tel: 04 72 72 26 64
Site internet:
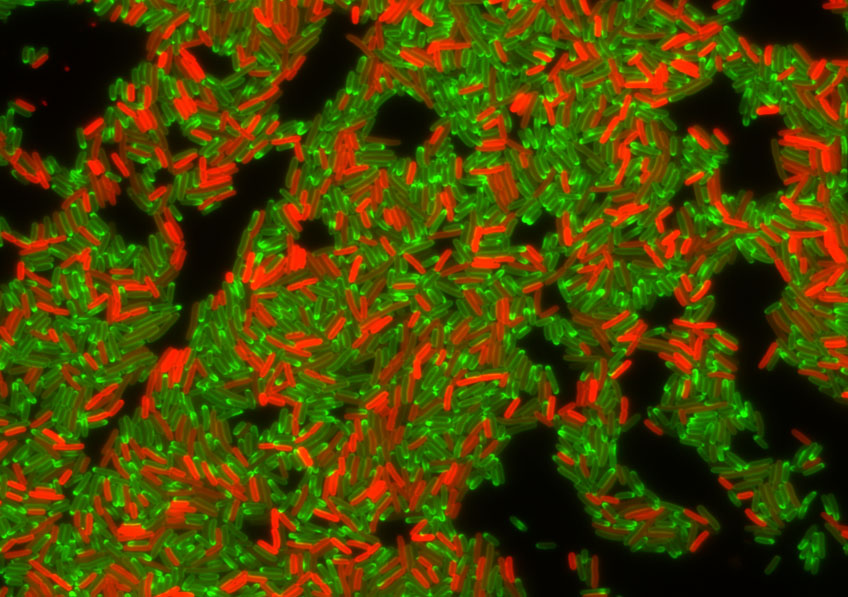
Population de bactéries résistantes aux antibiotiques visualisées en microscopie à fluorescence en cellules vivantes. Cette population d’Escherichia coli possède un plasmide conjugatif qui code la protéine TetA (en rouge), une pompe à efflux responsable de la résistance à la tétracycline (en vert). On voit une claire anti-corrélation entre la présence de TetA et la présence de tétracycline dans les cellules. Bien que génétiquement identiques certaines bactéries parviennent à produire TetA et rejeter la tétracycline, lorsque d’autres accumulent l’antibiotique et ne parviennent pas à développer la résistance.©Christian Lesterlin
La dissémination globale de résistances aux antibiotiques est un problème majeur de santé publique et une priorité de la recherche internationale en microbiologie. Dans ses travaux à paraître dans Science, Christian Lesterlin, chercheur Inserm au sein du laboratoire » Microbiologie moléculaire et biochimie structurale « (CNRS/Université Claude Bernard Lyon 1) à Lyon, a pu filmer avec son équipe le processus d’acquisition de l’antibiorésistance en temps réel, et a découvert un acteur essentiel mais inattendu dans son maintien et dans sa dissémination au sein des populations bactériennes.
Cette dissémination de l’antibiorésistance est en grande partie due à la capacité qu’ont les bactéries d’échanger du matériel génétique par un processus appelé conjugaison bactérienne. Le séquençage systématique de souches pathogènes ou environnementales a permis d’identifier une grande variété d’éléments génétiques transmissibles par conjugaison et porteurs des résistances à la plupart, sinon à toutes les classes d’antibiotiques actuellement utilisés dans les traitements cliniques. En revanche, le processus de transfert in vivo du matériel génétique d’une bactérie à l’autre, le temps nécessaire à l’acquisition de cette résistance une fois le nouveau matériel génétique reçu et l’effet des molécules antibiotiques sur cette résistance étaient encore inconnus.
Une visualisation en temps réel
Les chercheurs ont choisi d’étudier l’acquisition de la résistance de la bactérie Escherichia coli à un antibiotique couramment utilisé, la tétracycline en mettant une bactérie sensible à l’antibiotique en présence d’une bactérie résistante. Des études précédentes ont montré que cette résistance repose sur sa capacité à évacuer l’antibiotique avant qu’il n’ait pu jouer son rôle destructeur grâce à des « pompes à efflux » situées sur sa membrane. Ces pompes à efflux spécifiques, sont capables d’éjecter les molécules antimicrobiennes en dehors de bactéries, leur conférant ainsi un certain niveau de résistance.
Dans cette expérience, la transmission de l’ADN d’une « pompe à efflux » spécifique – la pompe TetA – a été observée entre une bactérie résistante et une bactérie sensible par marquage fluorescent. Grâce à l’apport de la microscopie en cellule vivante, il suffisait alors de suivre la progression de la fluorescence pour voir, la manière dont l’ADN de la « pompe » migrait d’une bactérie à l’autre et comment il s’exprimait chez la bactérie receveuse.
Le transfert d’ADN des bactéries donneuses (vertes) aux bactéries receveuses (rouges) est révélé par l’apparition de foyers de localisation rouges. L’expression rapide des gènes nouvellement acquis est quant à elle révélée par la production de fluorescence verte dans les bactéries receveuses. Crédit vidéo : Christian Lesterlin/Inserm
Comment la résistance s’organise-t-elle en présence d’antibiotique?
Le mode d’action de la tétracycline est bien connu des scientifiques : elle entraine la mort des bactéries en se fixant sur leur machinerie traductionnelle bloquant ainsi toute possibilité de produire des protéines. En suivant ce raisonnement, lorsque l’antibiotique est introduit dans le milieu de culture précédent, la pompe à efflux TetA ne devrait pas être produite et les bactéries devraient mourir. Pourtant, les chercheurs ont observé que paradoxalement, les bactéries étaient capables de survivre et de développer la résistance efficacement, suggérant l’implication d’un autre facteur essentiel au processus d’acquisition de résistance.
Cette étude ouvre de nouvelles perspectives dans la recherche de mécanismes similaires chez d’autres bactéries que E.coli, et pour différents antibiotiques. « On pourrait même penser à une thérapie combinatoire qui allierait l’antibiotique et une molécule capable d’inhiber cette pompe généraliste. Même s’il est encore trop tôt pour envisager l’utilisation d’un tel inhibiteur dans une perspective thérapeutique, cette possibilité fait actuellement l’objet de nombreuses études car elle permettrait de réduire l’antibiorésistance, et d’empêcher sa dissémination aux différentes espèces de bactéries » conclut Christian Lesterlin.
Christian Lesterlin
Chercheur Inserm
Laboratoire de microbiologie moléculaire et biochimie structurale (MMSB)
CNRS-UMR5086-Lyon 1
Tel: 04 72 72 26 64
Site internet:
Protecting role of AcrAB-TolC multidrug efflux pump in drug- resistance acquisition by plasmid transfer
Sophie Nolivos, Julien Cayron, Annick Dedieu, Adeline Page, Frederic Delolme, Christian Lesterlin.
Molecular Microbiology and Structurale Biochemistry (MMSB), Université Lyon 1, CNRS, INSERM, UMR5086, 69007, Lyon, France
Protein Science Facility, SFR BioSciences CNRS UMS3444, Inserm US8, UCBL, ENS de Lyon, 50 Avenue Tony Garnier, 69007 Lyon, France.
Science, https://dx.doi.org/10.1126/science.aav6390 24 mai 2019