Comment les bactéries font elles pour infecter notre organisme ? Quelles « armes » leur permettent de passer à travers les mailles du filet de notre système immunitaire ? C’est ce que tente de comprendre l’équipe de Thomas Henry chercheur à l’Inserm et ses collaborateurs du CNRS de l’Université Claude Bernard Lyon 1 et de l’ENS de Lyon regroupés au sein du Centre international de recherche en infectiologie (CIRI). Dans un travail publié dans la revue Nature Communication les chercheurs se sont intéressés à un composant clé du mécanisme d’évasion des bactéries et trouvé chez l’homme, l’acteur majeur de leur détection.
Détecter la présence de l’ennemi est la première étape indispensable pour induire une réponse capable de le combattre. Au sein de l’organisme, c’est le rôle du système immunitaire. Celui-ci est confronté à différents types de pathogènes, et notamment aux bactéries qui usent de toutes les stratégies possibles et imaginables pour déjouer la surveillance du système immunitaire.
Normalement, au moment de l’invasion de l’organisme humain par les bactéries, c’est un des composants particulier de la paroi bactérienne – le LPS – qui les trahit et permet aux cellules humaines de reconnaitre et de déclencher une réponse immunitaire. Certaines bactéries échappent néanmoins plus souvent que d’autres au système immunitaire, et augmentent leur chance d’infecter l’organisme grâce à un LPS un peu plus discret.
Dans cette étude, les chercheurs se sont intéressés à une bactérie modèle, Francisella novicida, pour comprendre les mécanismes de défense de l’organisme contre les bactéries car pourvue de ce fameux « LPS discret ». Ces bactéries ont notamment la capacité de s’évader de l’intérieur des cellules de l’immunité innée (les macrophages) sensées les détruire.
L’organisation de l’évasion bactérienne
Normalement, l’arrivée de LPS dans le cytoplasme des macrophages est détectée et la réponse inflammatoire déclenchée, la mort de la cellule permettant de stopper la propagation du pathogène. En réalité, il s’agit d’une course permanente entre la multiplication de la bactérie et les systèmes de détection de la cellule hôte. Parmi les nombreux systèmes d’alarme dont dispose le macrophage, Aim2 a été identifié comme étant celui, chez la souris, capable de détecter l’arrivée de ces bactéries dans le cytoplasme. Mais impossible de reproduire le même résultat chez l’homme. Tout l’enjeu a été de comprendre dès lors, comment s’organise la riposte chez l’être humain.
L’organisation de la riposte : ensemble au bon moment !
Cette découverte explique aussi en partie pourquoi l’homme est plus susceptible que la souris au choc septique qui survient lorsque les bactéries envahissent le sang ou certains organes. La caspase 4 étant particulièrement sensible, les importantes quantités de LPS circulant dans le sang provoquent un emballement du système immunitaire avec des conséquences irréversibles pouvant conduire au décès. Malgré tout, la diversité des mécanismes de détection et leur redondance partielle, contribuent à ce que l’homme sorte le plus souvent vainqueur des rencontres avec des bactéries.
L’identification du fonctionnement de la caspase 4 et de ses cofacteurs représente une étape vers la mise en place de traitements anti-inflammatoires dans le choc septique.
[1] Inserm/CNRS/ENS Lyon/Université Claude Bernard Lyon 1
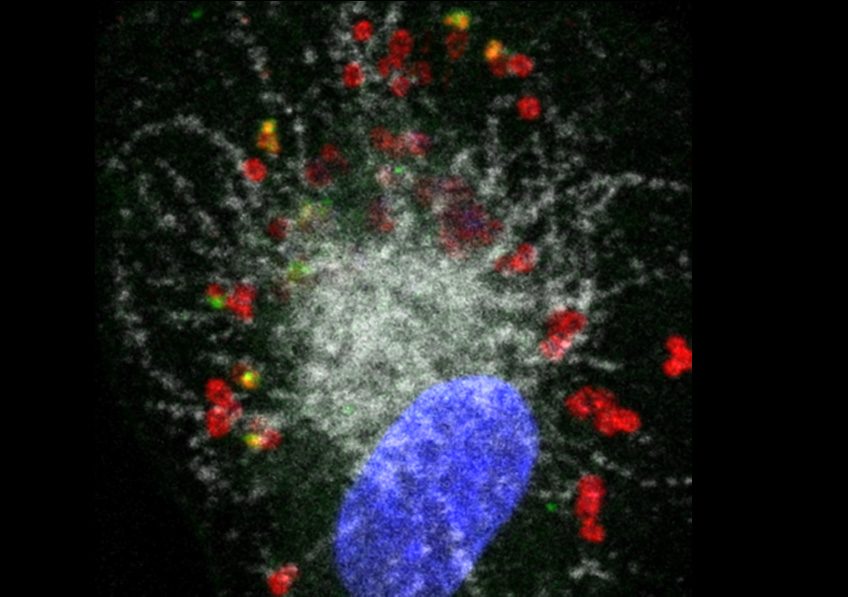
Légende photo :
Macrophage humain (noyau en bleu) infecté par Francisella novicida (en rouge). La bactérie s’est échappée du compartiment phago-lysosomal en blanc (un premier mécanisme de défense du macrophage) mais une autre protéine de défense GBP2 (en vert), détecte certaines bactéries et permet à la caspase-4 de déceler le LPS de Francisella et de mettre en place des réponses anti-bactériennes.