Contact Chercheur
Brice Felden
Directeur du laboratoire « ARN régulateurs bactériens et médecine »
(U 1230 Inserm/Université de Rennes 1)
E-mail : rf.1senner-vinu@nedlef.ecirb
Téléphone : +33 (0)2 23 23 48 51
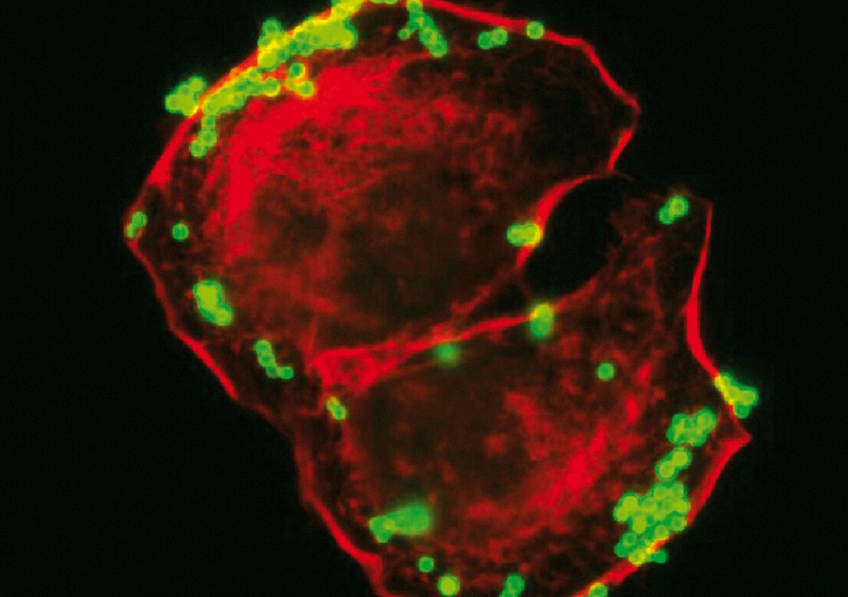
Staphylocoques dorés (bactéries Staphylococcus aureus) en vert adhérant à des kératinocytes, en rouge. © Inserm/Tristan, Anne
Les infections bactériennes dites « persistantes » constituent un problème de santé publique majeur. Elles sont associées à des échecs importants des traitements antibiotiques. Des chercheurs de l’Inserm et de l’Université de Rennes 1, en collaboration avec une équipe de recherche basée en Suisse, ont mis en évidence un nouveau mécanisme permettant d’expliquer l’entrée en persistance de la bactérie Staphylococcus aureus, ou staphylocoque doré. Ces travaux sont publiés dans la revue Nature Microbiology.
La persistance désigne la capacité de bactéries à survivre à des doses élevées d’antibiotiques, sans pour autant être résistantes. Elles deviennent persistantes en ralentissant leur croissance, un peu comme si elles entraient en « hibernation » pour se protéger des traitements antibiotiques. La présence de telles bactéries tolérantes aux antibiotiques représente un problème majeur de santé publique. En effet, lorsque les antibiotiques sont arrêtés, certaines d’entre elles se « réveillent » et sont susceptibles de se multiplier à nouveau. Le risque de rechute et d’infections bactériennes chroniques est alors très élevé.
La plupart des mécanismes menant à la formation de la persistance demeurent inconnus. Dans leur étude, les chercheurs de l’Inserm et de l’Université de Rennes 1 au sein du laboratoire « ARN régulateurs bactériens et médecine » se sont intéressés à la bactérie Staphylococcus aureus (le staphylocoque doré). Celle-ci arrive en tête des pathogènes responsables d’infections nosocomiales (infections contractées à l’hôpital) et est également impliquée dans de nombreuses intoxications alimentaires.
Lutter contre les infections bactériennes chroniques
Dans leurs travaux, les chercheurs se sont intéressés un ARN non codant des staphylocoques dorés, c’est-à-dire à un ARN non traduit en protéines.
Ils ont montré qu’une fois positionné sur les ribosomes[1] des staphylocoques, cet ARN (désigné sous le nom d’antitoxine SprF1) diminue la synthèse des protéines pendant la croissance de la bactérie (il s’agit du phénomène d’hibernation évoqué plus haut). Ce mécanisme favorise la formation de staphylocoques persistants qui deviennent insensibles aux antibiotiques.
« Nous mettons en évidence un processus moléculaire guidé par l’ARN où l’interaction entre cet ARN SprF1 et le ribosome est impliquée dans la formation de bactéries persistantes aux antibiotiques, elles-mêmes largement impliquées dans les infections staphylococciques chroniques », souligne Brice Felden, le professeur à l’Université de Rennes 1 qui a supervisé ces travaux.
Ces résultats permettent en outre d’envisager une nouvelle classe d’anti-infectieux ciblant les bactéries persistantes, et donc de nouveaux traitements pour les infections chroniques à staphylocoques dorés. « Forts de ces résultats, nous souhaitons utiliser développer des molécules contre les bactéries persistantes en ciblant l’antitoxine SprF1. Cette stratégie vise ainsi à compléter l’arsenal thérapeutique mis à disposition des cliniciens, qui sont de plus en plus confrontés à des maladies bactériennes chroniques », déclare Marie-Laure Pinel-Marie qui a coordonné ces travaux.
Ces résultats ont fait l’objet d’un dépôt de brevet européen.
[1] Des particules présentes dans toutes les cellules qui sont les « usines » à fabrication des protéines.
Brice Felden
Directeur du laboratoire « ARN régulateurs bactériens et médecine »
(U 1230 Inserm/Université de Rennes 1)
E-mail : rf.1senner-vinu@nedlef.ecirb
Téléphone : +33 (0)2 23 23 48 51
RNA antitoxin SprF1 binds ribosomes to attenuate translation and promote
persister cell formation in Staphylococcus aureus.
Marie-Laure Pinel-Marie1*†, Régine Brielle1*, Camille Riffaud1, Noëlla Germain Amiot1, Norbert Polacek2, and Brice Felden1†
1 Inserm, BRM [Bacterial Regulatory RNAs and Medicine] – UMR_S 1230, 35000 Rennes, France.
2 Department of Chemistry and Biochemistry, Bern University, 3012 Bern, Switzerland.
Nature Microbiology, janvier 2021.