Dans la glande mammaire, les canaux galactophores sont indispensables car ils sont les conduits par lesquels le lait est amené vers le mamelon. A l’intérieur des cellules qui les tapissent, les cellules luminales, les organites et protéines sont répartis de manière asymétrique. Cette « polarité » cellulaire est l’élément clé de leur bon fonctionnement.
Parmi les nombreux facteurs engagés dans l’établissement correct de cette polarité, les chercheurs d’une équipe anciennement localisée à l’institut Curie (Inserm/CNRS, Paris) maintenant au Grenoble Institut des Neurosciences (Inserm/Université Joseph Fourier) se sont intéressés à la huntingtine, plus connue pour son rôle dans la maladie de Huntington, une maladie neurodégénérative. De manière surprenante, elle est non seulement présente dans le cerveau mais aussi dans toutes les cellules du corps, et serait impliquée dans l’architecture et le développement de la glande mammaire.
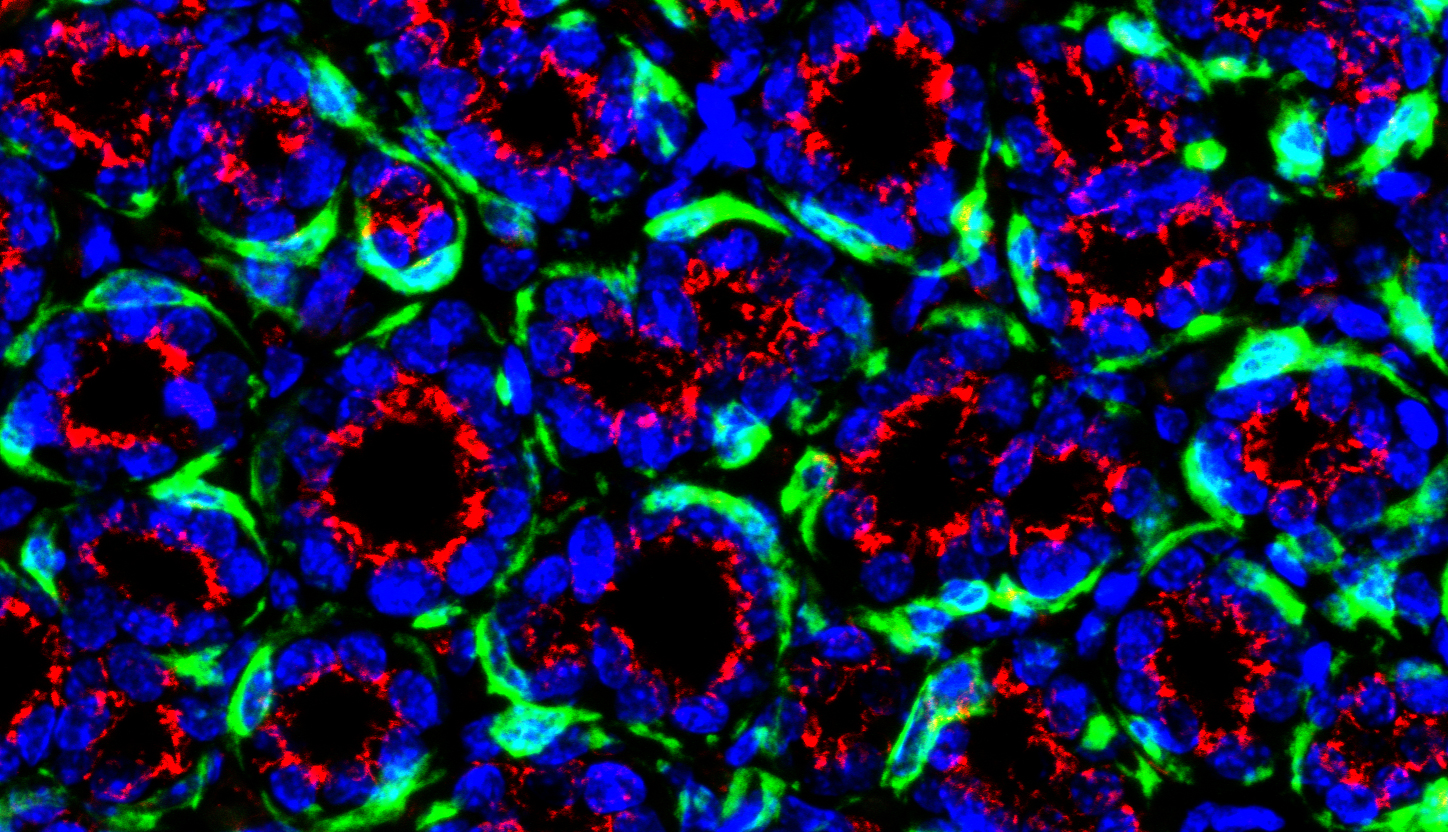
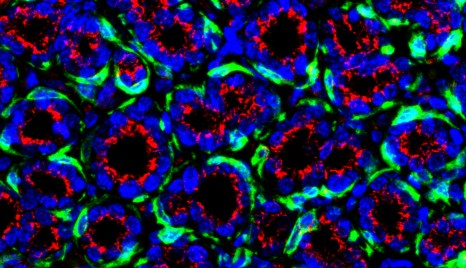
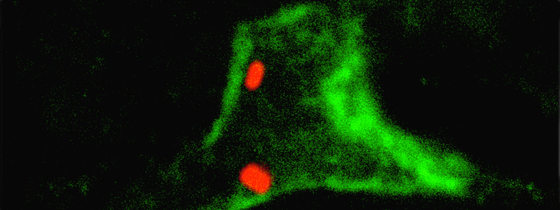
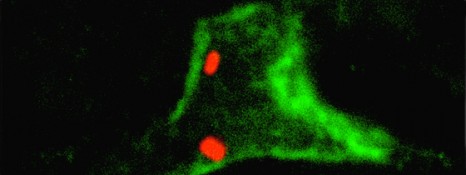
Section de glande mammaire marquée pour les cellules basales (vert), et un organite (appareil de Golgi, rouge). L’organite est localisé sur le noyau (bleu) des cellules luminales et témoigne de leur polarité. © Salah ELIAS.
Dans ces travaux menés par l’équipe de Sandrine Humbert et publiés dans Plos Biology, la huntingtine a été supprimée des cellules luminales chez des souris, puis, l’effet sur le développement des glandes et la lactation a été étudié. Les canaux galactophores des souris ayant perdu la huntingtine sont plus longs à se former et présentent une architecture anormale avec une lumière malformée. Parallèlement, la lactation est aussi affectée : l’abondance en protéines de lait est réduite et surtout, ces souris n’ont pas pu allaiter leurs souriceaux occasionnant de graves défauts de poids.
La huntingtine détermine la polarité de ces cellules, en interagissant avec de nombreux autres facteurs. Son absence perturbe cette polarité, ce qui est à l’origine des troubles fonctionnels et structurels observés dans la glande mammaire.
« Pendant la formation des tumeurs, on observe une désorganisation similaire de la polarité cellulaire. La caractérisation du rôle de la huntingtine est donc essentielle pour mieux comprendre le développement pathogénique à l’origine des cancers du sein » conclut Sandrine Humbert, directeur de recherche Inserm.