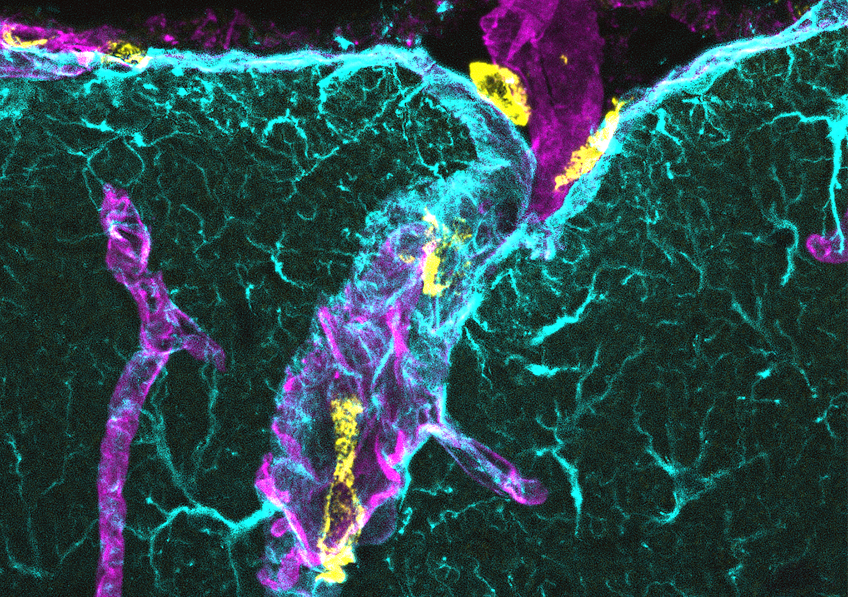
Visualisation, au sein de la barrière hémato-encéphalique, des macrophages associés au système nerveux central (CAM, en jaune), à l’interface entre un vaisseau sanguin (magenta) et des astrocytes (cyan), cellules de soutien des neurones en forme d’étoile. © Dr Damien Levard
Le vieillissement accroît fortement les risques de survenue d’un AVC ischémique. Une équipe de chercheuses et chercheurs de l’Inserm, du CHU Caen Normandie et de l’université de Caen Normandie s’est intéressée au rôle que pourraient jouer certaines cellules immunitaires, les macrophages associés au système nerveux central (CAMs), dans les atteintes neurologiques qui surviennent après un AVC. Leurs travaux montrent que ces cellules acquièrent au cours du vieillissement un rôle clé dans la régulation de la réponse immunitaire déclenchée à la suite d’un AVC. Ces travaux, parus dans Nature Neuroscience, mettent en évidence l’importance de la présence de ces cellules à l’interface entre le sang et le cerveau dans le maintien de l’intégrité cérébrale.
Parmi les accidents vasculaires cérébraux (AVC), le plus fréquent est l’AVC ischémique, qui résulte de l’obstruction d’une artère du cerveau par un caillot sanguin. L’âge est un facteur de risque majeur : à partir de 55 ans, pour 10 ans d’âge en plus, le risque d’AVC ischémique est multiplié par deux.
L’AVC ischémique est suivi de processus inflammatoires cérébraux susceptibles d’aggraver les lésions neurologiques. Les macrophages associés au système nerveux central (CAMs) sont des cellules immunitaires situées au sein de la barrière hémato-encéphalique[1], à l’interface entre la circulation sanguine et le parenchyme cérébral[2]. En temps normal, le rôle des CAMs est de surveiller leur environnement, de le nettoyer des débris et autres molécules provenant du parenchyme cérébral, ainsi que des molécules dérivées du sang qui passent la barrière hémato-encéphalique, et de signaler aux autres cellules immunitaires la présence de pathogènes. Peu étudiés jusqu’à présent, ils se trouvent pourtant dans une situation anatomique idéale pour détecter et réagir aux signaux inflammatoires provenant de l’extérieur et protéger le parenchyme cérébral.
Une équipe de recherche du laboratoire Physiopathologie et imagerie des maladies neurologiques (Inserm/Université de Caen Normandie), menée par Marina Rubio, chercheuse Inserm, et Denis Vivien, professeur et praticien hospitalier à l’université de Caen et au CHU Caen Normandie et responsable du laboratoire, s’est intéressée chez la souris et dans des tissus cérébraux humains à l’évolution du rôle des CAMs au cours du vieillissement et à leur implication potentielle dans la régulation de la réponse inflammatoire survenant dans le cerveau après un AVC ischémique.
Dans un premier temps, les scientifiques ont cherché à caractériser les évolutions du rôle des CAMs et de leur environnement biologique au cours du vieillissement. Ils ont ainsi pu observer que, si le nombre de CAMs ne fluctuait pas avec l’âge, leurs fonctions évoluaient ; une molécule spécifique apparaissait à leur surface : le récepteur MHC II, qui joue un rôle majeur dans la communication entre cellules immunitaires (par exemple pour coordonner la réponse immunitaire face à la présence d’un pathogène). Dans le même temps, la barrière hématoencéphalique, étanche dans les jeunes cerveaux, devenait, elle, plus poreuse, permettant alors le passage de certaines cellules immunitaires en provenance du sang vers le parenchyme cérébral.
« Ces observations suggèrent que les CAMs seraient capables d’adapter leur activité en fonction du stade de la vie, de l’état de santé de la personne et de la région du cerveau où ils se trouvent », précise Marina Rubio.
Ainsi, pour compenser l’augmentation de la porosité de la barrière hématoencéphalique avec l’âge, ils renforceraient leurs capacités de communication avec les autres cellules immunitaires en exprimant davantage le récepteur MHC II.
« À la suite d’un AVC ischémique, cela pourrait permettre de prévenir une réponse immunitaire trop importante qui aurait des conséquences neurologiques plus graves », ajoute la chercheuse.
L’équipe de recherche s’est ensuite intéressée à l’impact de ces changements fonctionnels sur la réponse immunitaire dans le parenchyme cérébral après un AVC ischémique. Pour ce faire, elle a comparé ce qu’il se produisait après un AVC dans un cerveau âgé normal de souris et ce qu’il se produisait en l’absence de CAMs ou lorsque leur récepteur MHC II était inhibé.
Dans ces deux derniers modèles, les chercheuses et les chercheurs ont pu observer que lors de la phase aiguë de l’AVC ischémique mais également dans les jours suivants, davantage de cellules immunitaires provenant du sang traversaient la barrière hémato-encéphalique, témoignant d’une perméabilité accrue de cette dernière, couplée à une réponse immunitaire exacerbée. Ce phénomène s’accompagnait d’une aggravation des atteintes neurologiques causées par l’AVC.
« Ces résultats suggèrent que les CAMs acquièrent, au cours du vieillissement, un rôle central dans l’orchestration du trafic des cellules immunitaires après un AVC ischémique, explique Denis Vivien. Grâce à leur capacité d’adaptation, ils assureraient un contrôle étroit continu de l’intégrité de la barrière hémato-encéphalique et de l’intensité de la réponse inflammatoire. »
Le récepteur MHC II porté par les CAMs semble être impliqué dans cette modulation ainsi que dans la limitation des atteintes neurologiques dues à l’AVC.
La suite des recherches pour cette équipe visera à mieux comprendre les mécanismes moléculaires intervenant dans le dialogue entre les CAMs et les cellules qui tapissent la paroi interne des vaisseaux sanguins cérébraux.
« L’objectif sera, à terme, d’identifier et de développer de nouvelles cibles thérapeutiques qui pourraient permettre de moduler la réponse immunitaire cérébrale de manière adaptée à chaque patient après un AVC », conclut Marina Rubio.
[1]La barrière hémato-encéphalique sépare les vaisseaux sanguins cérébraux du parenchyme cérébral. Elle joue un rôle de filtre fortement sélectif capable à la fois de laisser passer les nutriments essentiels pour le cerveau tout en protégeant le parenchyme des pathogènes, toxines ou hormones circulant dans le sang et susceptibles de réussir à sortir des vaisseaux.
[2]Le parenchyme cérébral est le tissu fonctionnel du cerveau directement impliqué dans les activités neuronales et la transmission de l’influx nerveux. Il est entouré par les espaces périvasculaires et les méninges où résident notamment les CAMs.
Ces contenus pourraient aussi vous intéresser :