
Une équipe internationale impliquant en France des chercheurs de l’Inserm, du CEA, et de l’APHP, a réussi à modéliser les facteurs de risque d’abus d’alcool au cours de l’adolescence. Les résultats de cette étude sont publiés en ligne le 02 juillet sur le site de la revue Nature.
En France, la consommation débute le plus souvent lors de l’adolescence. Actuellement, 80% des jeunes âgés de 17 ans admettent avoir consommé de l’alcool au cours des 30 derniers jours. De récentes études ont montré que les adolescents étaient particulièrement vulnérables aux effets neurotoxiques de l’alcool. Et une consommation précoce d’alcool constitue un facteur important de risque d’apparition d’une dépendance à l’alcool chez l’adulte.
Dans le cadre du projet de recherche européen IMAGEN dédié à l’étude des risques associés aux comportements chez l’adolescent, une équipe internationale, impliquant en France, au sein de l’I2BM, des chercheurs de l’INSERM*, du CEA, et de l’APHP, a réussi à modéliser les facteurs de risque de « binge drinking »[1] chez les adolescents de 14 ans. Ils impliquent avec un « poids » à peu près égal : des événements de vie, en premier lieu les événements amoureux ; des particularités de la structure et du fonctionnement cérébral régulant le plaisir et l’impulsivité ; et des traits de personnalité spécifiques. Le suivi des adolescents entre 14 et 16 ans révèle que ces facteurs ont une valeur prédictive du « binge drinking » à 16 ans; en outre, leur valeur prédictive a pu être généralisée aux autres types d’abus d’alcool à l’adolescence. L’étude suggère des facteurs de risque utiles pour la prévention ciblée de l’alcoolisme, et représente une approche scientifique multidisciplinaire exemplaire pour les autres troubles mentaux débutant à l’adolescence, sachant que près de la moitié des maladies psychiatriques débutent à cette période de la vie.
* Unité mixte INSERM – CEA 1000 « NeuroImagery & Psychiatry »
[1] Pratique associée à la consommation en grande quantité et très rapidement d’alcool chez les jeunes.
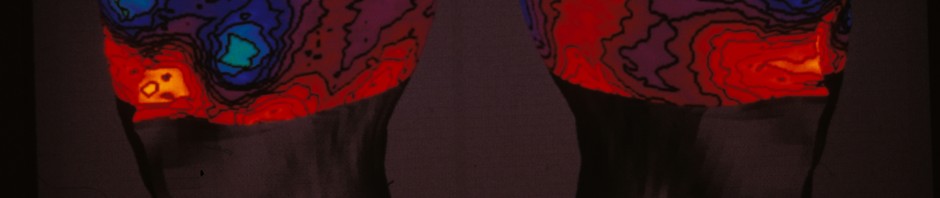
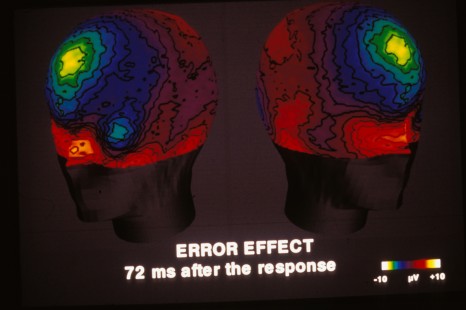
Lorsqu’on effectue un geste dans un but précis, ou en réponse à une sollicitation, il est impératif de pouvoir le corriger au cours de sa réalisation s’il s’avère inadapté. Une telle fonction conditionne la qualité de notre vie quotidienne, que ce soit dans l’activité motrice immédiate (ne pas « brûler » un feu lorsqu’il passe au rouge…), ou dans le comportement en société (attitudes adaptées aux circonstances). Des chercheurs du CNRS, de l’Inserm et d’Aix-Marseille Université viennent d’identifier le réseau neuronal qui contrôle nos actions et détecte nos erreurs. Grâce à des enregistrements directs de l’activité du cortex cérébral chez des patients en cours d’explorations neurochirurgicales, les chercheurs ont pu découvrir qu’une région du cortex frontal (l’Aire Motrice Supplémentaire ou AMS) est le nœud du réseau d’évaluation de nos actions conduisant à la détection des erreurs. Dans cet article publié le 21 février 2014 dans Science les chercheurs précisent les circuits cérébraux de cette auto-évaluation de nos actions ainsi que son mécanisme et sa relation avec la détection de comportements erronés par rapport à nos intentions.
 © Inserm
© Inserm
La leptine est une hormone secrétée par les cellules adipeuses et qui envoie le signal de satiété au cerveau. Parfois, certains individus en surpoids ou obèses développent une résistance à cette hormone qui ne parvient plus à délivrer son message. L’équipe de Vincent Prévot, directeur de recherche à l’Inserm au Centre de recherche Jean Pierre Aubert à Lille, vient de montrer chez la souris obèse comment réactiver la voie permettant le transport de la leptine jusqu’au cerveau.
L’obésité acquise par une alimentation trop riche en graisse est associée à des niveaux importants et anormaux de leptine circulante. Ces taux circulants reflètent l’incapacité de la leptine à arriver jusqu’au cerveau. Elle reste alors « piègée » dans la circulation. Dans cette étude publiée dans Cell Metabolism, les chercheurs ont réussi à trouver la porte d’entrée de cette hormone dans le cerveau et restauré l’ouverture de cette « porte cellulaire » chez des souris obèses.
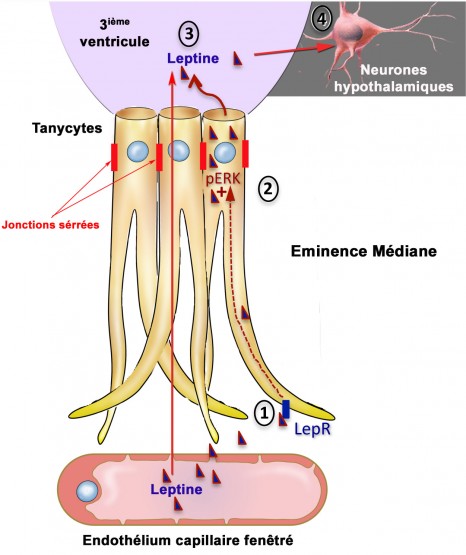
Le transport de la leptine via les tanycytes © Inserm / Vincent Prévot
L’équipe de recherche est parvenue dans un premier temps à décrire le mécanisme de passage de la leptine à travers cette porte cellulaire: les tanycytes (Figure ci-contre : cellules en jaune). Ces cellules capturent la leptine circulante à partir des vaisseaux sanguins qui, à cet endroit-là, ont la particularité de la laisser passer (étape 1). Lors de son parcours dans le tanycyte, la leptine capturée active une voie de signalisation « ERK » (étape 2) qui enclenche sa libération dans le liquide céphalorachidien (étape 3). La leptine active alors les zones cérébrales qui véhiculent son action anorexigène (étape 4).
Dans le cas d’obésité, les chercheurs ont constaté que le tanycyte est capable de capter l’hormone mais ne parvient plus à la libérer dans le cerveau. Il développe ce qu’on appelle « une leptinorésistance » liée à l’altération de l’activité de son récepteur appelé « LepR ». Les chercheurs ont alors testé chez la souris un traitement pharmacologique pour que la leptine parvienne jusqu’au LCR.
« Notre étude montre que, chez la souris obèse, le transport de la leptine à travers le tanycyte peut être restauré par un traitement pharmacologique en activant la voie de signalisation ERK dans cette cellule », explique Vincent Prévot, directeur de recherche à l’Inserm.
Ce traitement permet à la leptine d’activer les neurones et à terme de restaurer la sensibilité des souris à cette hormone en retrouvant progressivement un régime équilibré.
« L’altération du transport de la leptine par les tanycytes pourrait donc constituer le premier évènement physiopathologique conduisant à l’hormonorésistance centrale chez les individus en surpoids ou obèses » conclut-il.
Malgré ses effets bénéfiques contre la douleur, la prise de morphine s’accompagne d’effets indésirables divers tels que la constipation, la nausée, des vomissements, la dépression respiratoire et la dépendance potentielle à la molécule. L’équipe de recherche dirigée par Alain Eschalier, directeur de l’unité Inserm 1107 « Neuro-dol » à Clermont Ferrand, vient de montrer qu’il est possible de dissocier ces deux types d’effets en conservant l’effet analgésique souhaité, sans ses effets indésirables. Ces résultats sont publiés dans la revue Nature Communications le 17 décembre 2013.
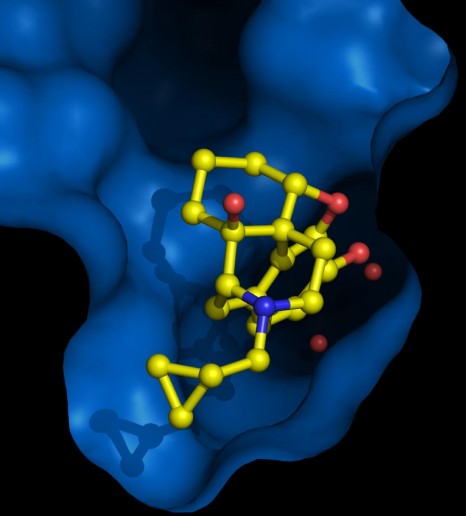
Visualisation en 3D du récepteur µ-opiacé lorsqu’il est associé à un antagoniste de la morphine © Kobilka Lab
Les effets bénéfiques et indésirables de la morphine et d’autres médicaments opioïdes dépendent du même récepteur « mu ». Pour les dissocier, les chercheurs ont travaillé sur des protéines situées en aval du récepteur. Ils ont sélectionné « TREK-1 », un canal inhibiteur de l’activité neuronale dont l’implication dans la douleur a été révélée dans de précédents travaux.
Dans cette étude, l’équipe de recherche montre, chez des souris, que ce canal est impliqué dans l’effet antalgique de la morphine sans participer à ses effets indésirables. En effet, lorsque le gène est supprimé chez les souris l’effet antalgique de la morphine testé dans des modèles de douleur clinique (de type post-opératoire par exemple) est réduit.
« Les canaux « TREK-1 » sont indispensables à l’effet antalgique de la morphine mais ne sont pas impliqués dans ses effets indésirables car ni la constipation, ni la dépression respiratoire, ni la dépendance physique ne sont modifiées chez les animaux délétés.
L’activation directe de ces canaux pourrait donc conduire à une analgésie de type morphine sans induire les effets secondaires liés à ce type de médicament, »
conclut Alain Eschalier, dernier auteur de l’étude.
L’équipe travaille actuellement sur la synthèse de nouvelles molécules activatrices de TREK-1 en collaboration avec les membres de l’Institut Analgesia (partenariat public-privé).

Chez les mammifères, la lumière est un élément indispensable au bon fonctionnement de l’organisme. Cette réaction à la lumière est gouvernée dans notre organisme par une horloge biologique. A l’image de rouages bien huilés, l’horloge centrale située dans une petite structure cérébrale appelée l’hypothalamus, synchronise à son tour de nombreuses horloges secondaires présentes dans d’autres aires cérébrales ainsi que certains organes périphériques. Ces horloges vont contrôler l’expression de nombreux gènes qui vont permettre à l’organisme de s’adapter quotidiennement à l’environnement.
Une perturbation des composants moléculaires de l’horloge biologique est fréquemment associée à des troubles psychiatriques, mais la question de causalité restait sans réponse jusqu’à présent.
Pour aborder cette question, l’équipe de chercheurs de l’Inserm dirigée par Emmanuel Valjent (Equipe ATIP/Avenir, Unité Inserm 661 Institut de Génomique Fonctionelle à Montpellier) a évalué une gamme de comportements associés aux maladies psychiatriques sur des souris chez lesquelles deux gènes essentiels de l’horloge circadienne (cryptochrome 1 et cryptochrome 2) ont été invalidés.
Leurs travaux ont permis de mettre en évidence des relations causales entre la perturbation des gènes codant pour les protéines cryptochrome1 et 2 (Cry 1 et 2) et des comportements associés à l’anxiété.
En effet, les souris déficientes pour les protéines Cry1 et 2, dont l’horloge est perturbée, montrent des altérations comportementales caractérisées entre autre par un niveau d’anxiété anormalement élevé.
Ceci se traduit chez les rongeurs par une aversion élevée des espaces ouverts. De manière intéressante, les souris déficientes pour l’une ou l’autre desprotéines Cry1 ou Cry2, dont l’horloge biologique n’est que peu altérée, montrent les mêmes altérations comportementales.
Ces résultats indiquent clairement qu’outre leurs rôles critiques dans la régulation de l’horloge moléculaire, ces protéines participent directement au contrôle de l’état émotionnel. Cette étude publiée dans la revue Frontiers in behavioral Neuroscience permet de mieux comprendre la relation complexe existante entre l’horloge biologique et des comportements associés aux maladies psychiatriques tels que l’anxiété.

Au bureau ou lors de la pratique d’un sport, vous avez surement été confronté à des situations de compétition ou au contraire des situations de collaboration, vous demandant d’atteindre un même objectif à plusieurs. S’il s’agit d’un objectif commun, nous avons tendance à diminuer notre effort personnel, et ce d’autant plus que le groupe est nombreux. A l’inverse dans un contexte de compétition, l’homme aura tendance à fournir un effort plus important, pour creuser l’écart avec ses concurrents.
Ces interactions collaboratives et compétitives avaient été auparavant étudiées dans le but de comprendre comment le cerveau fait des choix dans de tels contextes. Les mécanismes cognitifs qui motivent la production d’effort dans des situations sociales restaient mal compris et leur composante neuronale n’avait pas été explorée jusqu’ici. Une idée dominante est que la motivation fournie par le contexte social serait reliée à l’utilité personnelle que l’on retire d’un tel effort. Cette motivation diminuerait donc lors d’une collaboration et augmenterait dans une situation de concurrence.
En utilisant l’imagerie par résonance magnétique fonctionnelle, les chercheurs de l’Inserm ont analysé ce qu’il se passait dans le cerveau de participants humains tandis qu’ils produisaient un effort physique (serrer une pince pour gagner de l’argent) dans un contexte collaboratif ou compétitif.
Leurs travaux leur ont permis de constater que la motivation était en effet principalement déterminée par l’utilité personnelle de l’effort, utilité reflétée par l’activation des régions cérébrales consacrées à la récompense.
Cependant, les sujets moins « utilitaristes », davantage motivés par des situations collaboratives, ont montré une activité plus intense et un volume anatomique plus important dans une région cérébrale impliquée précédemment dans la conduite des interactions sociales.
Cette région pourrait générer une motivation purement pro-sociale, permettant de produire un plus grand effort dans un contexte de collaboration. Plus généralement, cette découverte suggère que l’architecture de notre cerveau contient des indices quant à notre propension à investir de l’énergie dans un travail collaboratif. Alors quel est votre profil ? Compétiteur ou collaborateur ?
Les morts soudaines inattendues dans l’épilepsie (SUDEP pour Sudden unexpected death in epilepsy) représentent une des causes les plus fréquentes de décès brutal non accidentel chez l’adulte jeune. L’origine des SUDEP reste méconnue car survenant en général la nuit en l’absence de témoins. Il arrive que les SUDEP surviennent à l’hôpital où les fonctions vitales sont surveillées par des enregistrements. Ce sont ces données que le Prof. Philippe Ryvlin, responsable de l’équipe Inserm « TIGER- recherche translationnelle et intégrative en épilepsie » au centre de recherche en neurosciences de Lyon, a analysé pour mieux comprendre ce phénomène.
L’étude internationale MORTEMUS, dont les résultats sont publiés dans la revue The Lancet Neurology datée du 4 septembre, a permis d’identifier et d’évaluer ces cas rares d’arrêts cardiorespiratoires survenus à l’hôpital dans les unités spécialisées dans l’épilepsie. Au total, 16 cas de SUDEP ont été analysés grâce aux données recueillies auprès de 147 unités localisées en Europe, Israël, Australie et Nouvelle-Zélande entre janvier 2008 et décembre 2009. La majorité des cas de SUDEP étudiés sont survenus la nuit (14 sur 16).
Les résultats montrent que les patients morts de SUDEP présentent la même succession d’événements conduisant à l’arrêt cardiovasculaire. La respiration s’intensifie (18 à 50 mouvements respiratoires par minute) suite à une crise sévère et cette accélération est suivie dans les 3 minutes d’un collapsus cardiorespiratoire soudain, transitoire ou terminal. Lorsqu’il est transitoire, les chercheurs ont observé que le dysfonctionnement survient de nouveau après quelques minutes, conduisant à une apnée terminale suivi dans un second temps d’un arrêt cardiaque.
Par ailleurs, cette étude mets le doigt sur la surveillance sous-optimale des patients admis dans des unités spécialisées d’épileptologie, invitant à renforcer les mesures de sécurité dans ces unités.
« Nos données permettent de lever le voile sur la cause de ces décès et apporte des éléments pour favoriser la prévention de ces morts soudaines, par exemple en améliorant la surveillance des patients dans les unités hospitalières spécialisées, en particulier pendant la nuit »
explique le Prof. Philippe Ryvlin, responsable de l’équipe Inserm.
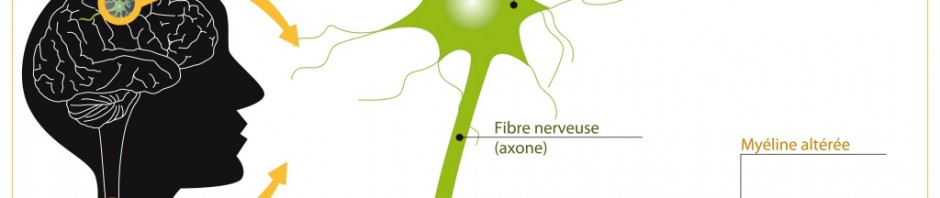
Une équipe de chercheurs dirigée par Brahim Nait Oumesmar, directeur de recherche Inserm au Centre de recherche du cerveau et de la moelle épinière (CRICM) en collaboration avec l’Université du Luxembourg, vient de découvrir qu’une nouvelle molécule est capable de stimuler la réparation de la myéline détruite dans des modèles expérimentaux de sclérose en plaques. Une avancée publiée dans The Journal of Neuroscience.
La sclérose en plaques (SEP) constitue la cause la plus fréquente d’invalidité neurologique chez le jeune adulte[1]. Cette maladie est caractérisée par des lésions inflammatoires du cerveau, de la moelle épinière et du nerf optique. Elle est considérée comme une maladie auto-immune: chez les personnes atteintes de SEP, leur système de défense est dérégulé. Au lieu de lutter contre les pathogènes extérieurs, le système immunitaire s’attaque à ses propres cellules.
La SEP entraîne la destruction des gaines de myéline qui entourent les neurones et qui facilitent le transport des informations. Des lésions chroniques caractérisées par une perte des fibres nerveuses apparaissent. Bien que les causes de la SEP restent encore inconnues, les traitements actuels visent surtout à moduler la réponse immunitaire, et ont très peu d’impact sur la réparation des gaines de myéline (ou remyélinisation). Trouver des traitements visant à stimuler la remyélinisation est donc un axe de recherche majeur dans la SEP. La remyélinisation pourrait permettre le rétablissement de la conduction nerveuse et prévenir la progression du handicap chez les patients atteints de SEP.
L’équipe de recherche dirigée par Brahim Nait Oumesmar directeur de recherche Inserm au Centre de recherche du cerveau et de la moelle épinière (CRICM) en collaboration avec l’Université du Luxembourg, a identifié une nouvelle molécule de synthèse capable de stimuler la réparation des lésions de la myéline dans des modèles expérimentaux de la SEP.
Cette molécule de synthèse baptisée TFA-12 fait partie d’un dérivé de la vitamine E.
Leurs travaux ont démontré que TFA-12 réduit à la fois la formation de lésions inflammatoires et surtout favorise la réparation des lésions de la myéline.
Ces recherches ont aussi montré que cette molécule stimule la régénération des oligodendrocytes, les cellules à l’origine de la synthèse de myéline dans le système nerveux central. Ces travaux pourraient ainsi permettre le développement de nouvelles stratégies pharmacologiques favorisant la remyélinisation des neurones dans la SEP.
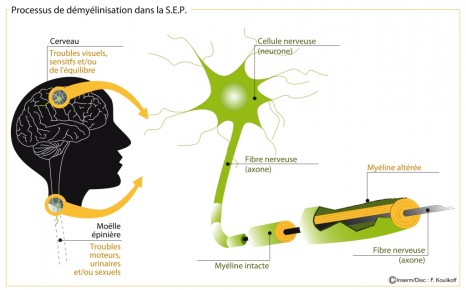
[1] L’âge moyen de début des symptômes est de 30 ans, cette maladie touche plus particulièrement les femmes. En France, 80 000 personnes seraient atteintes par la SEP

Un consortium international vient de révéler 5 nouvelles régions génétiques associées à la migraine dans une étude publiée le 23 juin 2013 dans la revue Nature Genetics , portant le nombre total de régions identifiées ces dernières années à 12. Les chercheurs de l’Unité Inserm 708 « Neuroépidémiologie » à Bordeaux ont participé à ce travail titanesque en comparant près de 118 000 données de patients souffrant ou non de migraines, issues de 29 études génomiques différentes.
La migraine est une variété de maux de tête répétitifs caractérisés par des douleurs de forte intensité et d’autres symptômes tels que les nausées, la sensibilité à la lumière, au bruit. Elle affecte près d’un adulte sur cinq. L »étude de ses origines reste difficile du fait de son caractère épisodique mais très récemment, plusieurs marqueurs génétiques ont été associés à la migraine.
Dans cette nouvelle étude, les chercheurs ont dénombré 12 régions génétiques associées à la migraine. 7 d’entre elles avaient déjà été rapportées et 5 nouvelles ont été identifiées.
L’étude montre que certaines d’entre elles se trouvent à proximité de gènes de contrôle des circuits cérébraux et de gènes responsables du maintien en bonne santé des tissus cérébraux.
« Les résultats obtenus à partir de cette très grande base de données permettront de déterminer les mécanismes biologiques à l’origine des migraines » explique Tobias Kurth, directeur de recherche Inserm à l’unité Inserm 708 « Neuroépidémiologie ». Nous pensons que la plupart de ces gènes sont interconnectés et pourraient déréguler les tissus cérébraux entrainant les symptômes de la migraine » ajoute-t-il.
Les chercheurs ont également identifié 134 régions génétiques supplémentaires potentiellement associées à la susceptibilité de l’individu à développer une migraine.
Un gène impliqué dans les épilepsies dites « focales », les plus fréquentes d’entre elles, a été découvert par l’équipe de recherche dirigée par Eric Leguern et Stéphanie Baulac de l’unité Inserm 975 « Génétique et physiopathologie des épilepsies familiales » à l’Institut du Cerveau et de la Moelle (ICM) de l’hôpital de la Pitié-Salpêtrière. Les chercheurs ont étudié des familles dont les membres atteints présentaient divers syndromes d’épilepsie focale. Dans 37% des familles, des mutations ont été retrouvées dans un gène commun. Cette découverte permet d’envisager de nouveaux mécanismes pour mieux comprendre cette pathologie. Les résultats de cette étude sont publiés dans une lettre de la revue Nature Genetics datée du 31 mars 2013.
Les épilepsies focales représentent près de 70% de toutes les épilepsies. Parmi elles, plusieurs syndromes familiaux ont été identifiés, et caractérisés par la localisation du foyer épileptogène à l’origine des crises: les épilepsies frontales nocturnes autosomiques dominantes, les épilepsies familiales du lobe temporal et les épilepsies familiales à foyer variable.
Grace à la caractérisation clinique de 16 familles, en collaboration avec des cliniciens des hôpitaux universitaires de Strasbourg, les chercheurs viennent de découvrir un gène majeur impliqué dans plusieurs formes familiales d’épilepsie focale. La technique de séquençage de l’ADN à haut débit a permis d’identifier une mutation introduisant un décalage dans la lecture du gène DEPDC5 (DEP domain containing protein 5), qui code pour une protéine de fonction encore inconnue. Par la suite, le séquençage du gène a révélé la présence de mutations dans 6 familles de la cohorte sur 16, soit plus du tiers d’entre elles. La fréquence élevée des mutations dans le gène DEPDC5 laisse entrevoir des retombées pour les patients et les familles en terme de diagnostic moléculaire et clinique.
« L’identification de mutations dans des familles avec épilepsie frontale, temporale ou à foyer variable démontre que ce gène est un dénominateur commun à des syndromes épileptiques longtemps considérés comme distincts du fait de la localisation cérébrale différente du foyer et de l’expression électro-clinique différente observée lors des crises »
, souligne Stéphanie Baulac, chargée de recherche à l’Inserm. Ces résultats suggèrent pour la première fois que le site d’initiation des crises est dissocié de la cause moléculaire.
Cette découverte permettra d’ouvrir de nouvelles pistes pour une meilleure compréhension des mécanismes pathologiques des épilepsies pour le développement de nouvelles cibles thérapeutiques, les épilepsies focales faisant partie des plus pharmaco-résistantes.
Ces travaux ont bénéficié d’un financement de l’Institut Hospitalo-Universitaire IHU-A-ICM dans le cadre des “Investissements d’avenir”.
Photo: ©Inserm / L.Peris











