Une étude conduite par l’équipe d’Ali Amara au sein de l’Unité mixte Inserm/CNRS-Université Paris Diderot « Pathologie et virologie moléculaire », à l’Hôpital Saint-Louis, à Paris, en collaboration avec des équipes de l’Institut Pasteur Paris et du Salk Institute à San Diego a permis d’identifier deux familles de récepteurs qui jouent un rôle important dans l’entrée du virus de la dengue dans les cellules. En montrant qu’il est possible d’inhiber in vitro l’infection virale en bloquant la liaison du virus sur ces récepteurs, les chercheurs ouvrent la voie à la possibilité d’une nouvelle stratégie antivirale. Ces travaux, sont publiés online sur le site de la revue Cell Host & Microbe le 18 octobre 2012.
Le virus de la dengue (VD), qui circule sous quatre formes différentes (quatre sérotypes), est transmis à l’homme par des moustiques. Il constitue un problème majeur de santé publique. Dans le monde, deux milliards de personnes sont exposées au risque d’infection et 50 millions de cas de dengue sont recensés par l’OMS chaque année. L’infection souvent asymptomatique ou s’apparentant à un état grippal peut conduire, dans ses formes sévères, à des fièvres hémorragiques fatales. Il n’existe pas actuellement de vaccin préventif ou de traitements antiviraux efficaces contre les quatre sérotypes du VD. Le développement de nouvelles stratégies thérapeutiques reste donc un enjeu important.
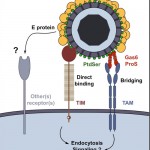
L’équipe dirigée par Ali Amara a réalisé un criblage génétique pour identifier des récepteurs cellulaires utilisés par le VD pour pénétrer dans les cellules cibles[1].Les chercheurs ont déterminé le rôle important que jouent les récepteurs TIM (TIM-1, 3, 4) et TAM (AXL et TYRO-3) dans le processus d’entrée des quatre sérotypes du VD.
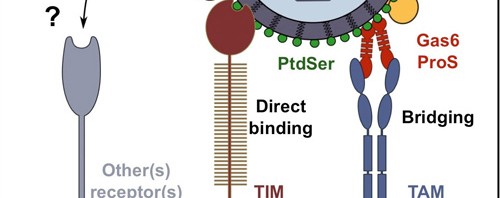
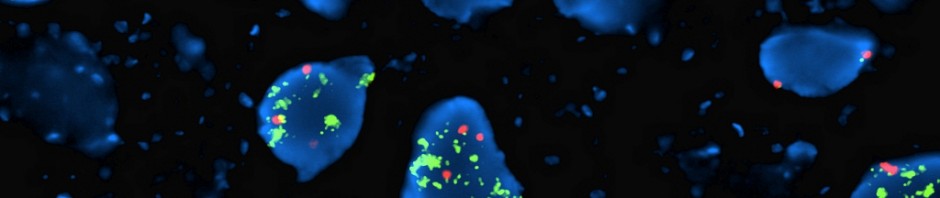
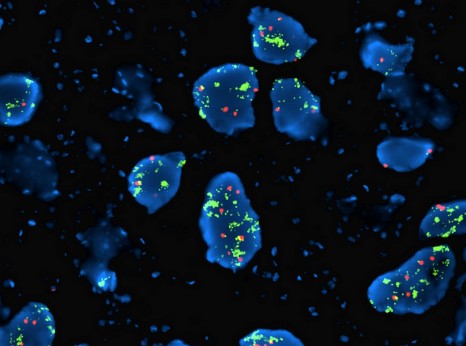
Exemple de reconnaissance directe et indirecte du virus de la dengue par les récepteurs TIM et TAM
©Cell Host & Microbe – Ali Amara
En effet, l’équipe d’Ali Amara a réussi à montrer que l’expression de ces 2 familles de récepteurs rend les cellules plus facilement infectables. De plus, les chercheurs ont observé que des anticorps ou des RNA interférents ciblant les molécules TIM et TAM réduisaient considérablement l’infection des cellules cibles par le VD.
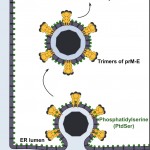
Les TIM et TAM appartiennent à deux familles distinctes de récepteurs transmembranaires qui interagissent directement (TIM) ou indirectement (TAM) avec la phosphatidylserine, un signal de type « mange moi » permettant la phagocytose et l’élimination des cellules apoptotiques. De façon inattendue, les travaux des chercheurs de l’Inserm ont montré que la phosphatidylserine était abondamment exprimée à la surface des particules virales, et que sa reconnaissance par les récepteurs TIM et TAM est essentielle à l’infection des cellules cibles.
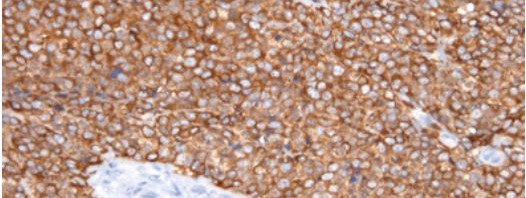
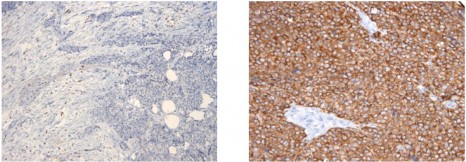
Répresentation schématique du signal de type « mange moi » permettant la phagocytose et l’élimination des cellules apoptotiques
©Cell Host & Microbe – Ali Amara
Ces résultats contribuent à élucider la première étape clé du cycle infectieux du VD, et mettent en évidence un nouveau mécanisme d’entrée du VD par mimétisme des fonctions biologiques impliquées dans l’élimination des cellules apoptotiques. La découverte de ces nouveaux récepteurs ouvre également la voie à de nouvelles stratégies antivirales ciblées sur le blocage de la liaison du VD sur les TIM et TAM.
Ces travaux de recherche ont fait l’objet d’une protection par dépôt de demande de brevet par Inserm Transfert.
[1] A ce jour, uniquement les récepteurs DC-SIGN et son homologue L-SIGN sont connus pour exercer un rôle actif dans le processus d’entrée du VD dans les cellules cibles