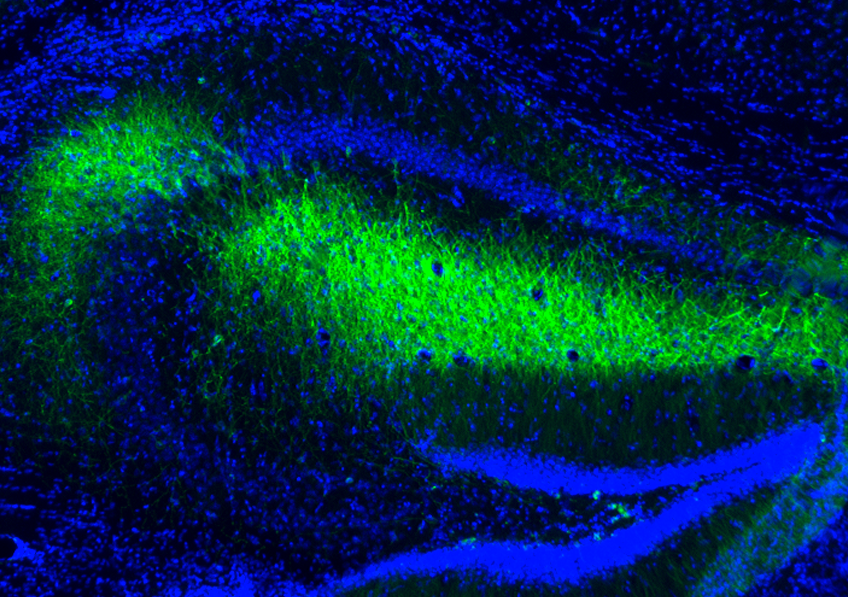
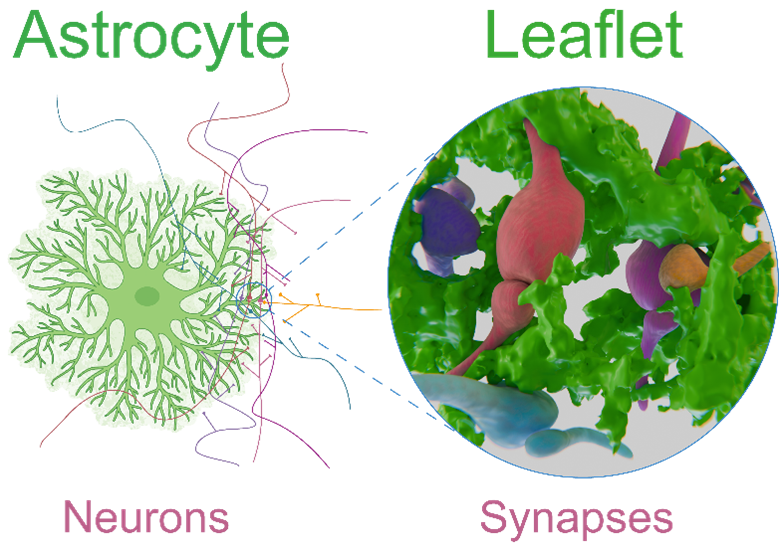
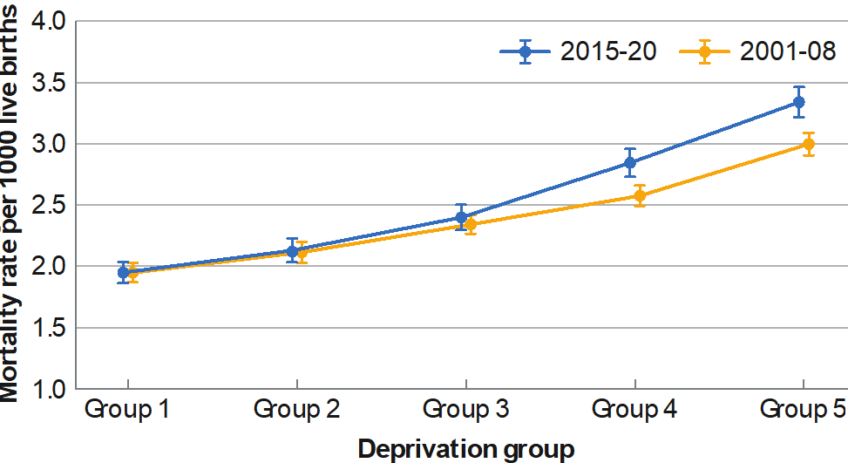
 Les astrocytes sont des cellules présentes dans tout le cerveau. Chaque astrocyte est en contact avec plusieurs neurones et plus de 100 000 synapses. Une nouvelle étude montre qu’au niveau microscopique, des dizaines de synapses provenant de circuits neuronaux distincts se rassemblent autour d’une seule structure spécialisée des astrocytes appelée leaflet, capable de détecter et d’intégrer les activités de plusieurs synapses. A droite : rendu en 3D réalisé par l’artiste Rémi Greco à partir de données réelles. © Lucas Benoit et Rémi Greco/ GIN
Les astrocytes sont des cellules présentes dans tout le cerveau. Chaque astrocyte est en contact avec plusieurs neurones et plus de 100 000 synapses. Une nouvelle étude montre qu’au niveau microscopique, des dizaines de synapses provenant de circuits neuronaux distincts se rassemblent autour d’une seule structure spécialisée des astrocytes appelée leaflet, capable de détecter et d’intégrer les activités de plusieurs synapses. A droite : rendu en 3D réalisé par l’artiste Rémi Greco à partir de données réelles. © Lucas Benoit et Rémi Greco/ GIN
Une étude collaborative franco-suisse associant les universités de Lausanne, de Genève, de Grenoble, l’Inserm et le Wyss center for bio and Neuroengenering, révèle un rôle inédit des astrocytes dans le traitement de l’information par le cerveau. Publiée dans la revue Cell, elle montre que ces cellules gliales sont capables d’intégrer des signaux issus de plusieurs neurones à la fois – un bouleversement conceptuel dans notre compréhension du cerveau.
Le cerveau ne fonctionne pas uniquement grâce aux neurones. En réalité, près de la moitié des cellules qui le composent sont des cellules gliales, et parmi elles, les astrocytes occupent une place à part. Leur nom provient de leur squelette en forme d’étoile en branches, mais leur apparence externe fait plutôt penser à certaines étoiles nébuleuses aux contours filamentaires qui leur permet de s’insérer dans les moindres interstices laissés libres entre neurones, vaisseaux sanguins et autres cellules. Ils sont ainsi en contact étroit avec les synapses, ces points de communication entre neurones.
De ce fait, depuis les années 1990, les neuroscientifiques soupçonnent que les astrocytes participent activement à la transmission de l’information en utilisant le calcium comme molécule messagère. Ce petit composant chimique peut déclencher une cascade de réactions dans la cellule, notamment la libération de transmetteurs moléculaires pouvant agir sur la modulation de l’activité synaptique. Pour que ces signaux se produisent, une structure interne appelée réticulum endoplasmique (RE) est essentielle : elle stocke le calcium et le relâche sous certaines conditions. Malgré les nombreuses hypothèses, les rôles exacts de ces signaux calciques restaient flous, en particulier dans les zones les plus fines des astrocytes au contact direct des synapses, car particulièrement difficiles à observer en raison de leur minuscule taille. Une équipe de recherche réunissant les universités de Lausanne (Unil) et genève (UNIGE), l’Inserm et l’Université Grenoble Alpes (Institut des neurosciences de Grenoble, GIN) et le Wyss Center for Bio and Neuroengineering vient de combler cette lacune.
Au-delà de la simple synapse
Jusqu’à présent, les astrocytes étaient perçus comme des cellules agissant à la marge des synapses neuronales. Le modèle dit de la « synapse tripartite » leur attribuait un rôle auxiliaire: moduler l’activité entre deux neurones. Mais l’étude récente dévoile un rôle bien plus central : les astrocytes ne se contentent pas d’interagir avec une seule synapse, ils coordonnent simultanément plusieurs entrées synaptiques issues de neurones différents pour atteindre un niveau augmenté d’intégration spatiale et temporelle de l’information.
L’étude, publiée dans la revue scientifique Cell le 24 septembre, révèle que des extensions particulières de la membrane des astrocytes, baptisées leaflets, enveloppent les synapses, contiennent des RE, et sont interconnectées entre elles à travers des tunnels appelés jonctions gap pour former un domaine fonctionnel unique. Dans chacun de ces domaines, une petite quantité de calcium est libérée chaque fois qu’une synapse voisine est active. Ainsi, un leaflet peut intégrer les signaux d’une dizaine, voire plus, de neurones différents. Ces domaines libèrent ensuite des plus grandes quantités de calcium, reflétant l’intégration des différents signaux neuronaux reçus. Ce calcium favorise alors la libération de facteurs capables de contrôler la communication entre les synapses enveloppées dans le leaflet.
Loin d’un simple relais, les scientifiques considèrent ainsi les astrocytes comme des éléments de calcul actif du cerveau.
« Nous avons démontré pour la première fois que les astrocytes ne se limitent pas à réagir à une synapse isolée, mais qu’ils peuvent intégrer les signaux de circuits neuronaux entiers. Cela ouvre la porte à de nouvelles fonctions cognitives portées par ces cellules gliales », explique Andrea Volterra du Département des neurosciences fondamentales de l’Unil, professeur honoraire à la Faculté de biologie et de médecine et codirecteur de l’étude.
Explorer les moindres recoins du cerveau
Pour observer ces interactions inédites, l’équipe a combiné deux techniques de pointe: une microscopie électronique volumétrique à résolution nanoscopique et une technique de microscopie optique. « Nous l’avons spécifiquement développée pour cette étude afin d’être capable de visualiser les changements de calcium sur de tout petits volumes », indique Nicolas Liaudet, ingénieur à l’UNIGE et coauteur de l’étude. Cette approche a permis de visualiser les leaflets dans leur environnement exact et d’évaluer à la fois leur composition, leur connectivité et leur rôle dynamique.
« Notre synergie méthodologique a joué un rôle déterminant afin d’atteindre ce nouveau niveau de compréhension », indique Karin Pernet-Gallay, ingénieure de recherche à l’Inserm, directrice de la plateforme de microscopie électronique à l’Institut des neurosciences de Grenoble (Inserm-Université Grenoble Alpes) et codirectrice de l’étude.
Ces leaflets, de taille inférieure à 250 nanomètres, partent du corps cellulaire de l’astrocyte ou de ses prolongements principaux. Ils ne contiennent pas de mitochondries, mais possèdent des fragments de réticulum endoplasmique (RE) et la machinerie moléculaire capable de générer de petits signaux calciques. Ces extensions sont assez proches des synapses pour en répondre aux signaux et interconnectés entre eux pour coordonner des réponses plus larges. En supprimant génétiquement une partie de la machinerie moléculaire responsable de la signalisation calcique dans les astrocytes, l’équipe de recherche a pu démontrer que cette signalisation naît dans les leaflets à la suite de l’activité des synapses.
Andrea Volterra précise que les leaflets sont en quelque sorte « des tours de contrôle biochimique en réseau, indépendants du reste de l’astrocyte. Ils semblent être là pour surveiller et coordonner les informations circulant dans chaque trajectoire synaptique selon un plan de niveau supérieur.»
Des fonctions cognitives et cliniques à explorer
Les résultats de l’étude montrent que l’activité des astrocytes est corrélée aux signaux neuronaux synaptiques, mais aussi qu’elle est amplifiée quand plusieurs neurones sont actifs en même temps. Cette capacité d’intégration fait potentiellement des astrocytes des contrôleurs à grande échelle de l’activité cérébrale, et non pas de simples régulateurs locaux d’une seule synapse.
Ces découvertes offrent de nouvelles pistes pour comprendre les fonctions supérieures du cerveau comme la mémoire, les émotions, la conscience et la prise de décision. Elles pourraient également expliquer certains dysfonctionnements neuronaux observés dans des pathologies cérébrales.
« Il est probable que les astrocytes jouent un rôle protecteur ou aggravant selon les contextes pathologiques. Nous allons maintenant étudier leur implication dans la mémoire et les dégénérescences neurocognitives comme la maladie d’Alzheimer », conclut Andrea Volterra.

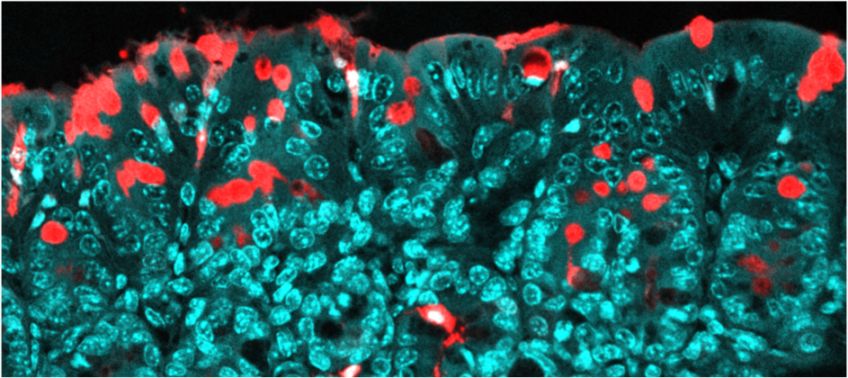 Passage de molécules au travers de l’épithélium du colon, via des voies spécialisées (les cellules de goblet). En rouge : les molécules transportées (antigènes) ; en bleu : l’épithélium. © Institut Pasteur/Interactions Microbiote-Hôte/Clara Delaroque et Benoit Chassaing
Passage de molécules au travers de l’épithélium du colon, via des voies spécialisées (les cellules de goblet). En rouge : les molécules transportées (antigènes) ; en bleu : l’épithélium. © Institut Pasteur/Interactions Microbiote-Hôte/Clara Delaroque et Benoit Chassaing







 L’eczéma du nourrisson se manifeste par des démangeaisons intenses et des rougeurs sur le visage, le cou ou le ventre (image d’illustration). © Adobe stock
L’eczéma du nourrisson se manifeste par des démangeaisons intenses et des rougeurs sur le visage, le cou ou le ventre (image d’illustration). © Adobe stock