 © Fotalia
© Fotalia
Pour la première fois, des chercheurs de l’Institut Curie, du CNRS et de l’Inserm révèlent que des acides gras s’accumulent à l’intérieur de gouttelettes lipidiques dans les cas les plus graves de médulloblastome, une des tumeurs cérébrales malignes la plus fréquente chez l’enfant. Menés en étroite collaboration en Ile-de-France avec deux équipes aux États-Unis et une équipe Toulousaine, ces travaux montrent également que, si on altère ce stockage d’acides gras, les cellules tumorales deviennent fortement vulnérables et meurent. Ces résultats ouvrent de nouvelles pistes thérapeutiques ciblées et font l’objet d’une publication dans Cancer Cell le 15 janvier 2026.
Ces travaux, soutenus notamment par la Ligue contre le cancer et l’INCa, s’inscrivent dans le cadre du programme de recherche exploratoires Identités et destins cellulaires (PEPR Cell-ID), un programme national d’envergure copiloté par le CNRS et l’Inserm et financé par France 2030.
Le médulloblastome est un cancer pédiatrique rare qui se développe au niveau du cervelet. Tumeur cérébrale maligne parmi les plus fréquentes chez l’enfant, les médulloblastomes demeurent particulièrement difficiles à traiter dans leurs formes les plus graves.
Depuis plus de vingt ans, les chercheurs étudient les différents types de médulloblastomes et sont parvenus à mettre en évidence quatre sous-groupes principaux (Wingless, Sonic Hedgehog, groupe 3 et groupe 4) grâce à l’identification des mutations ADN et des variations dans l’expression de certains gènes. Cependant, ces avancées ne suffisent pas à éclairer l’ensemble des mécanismes de ce cancer pédiatrique.
Une cohorte internationale unique de médulloblastomes
Afin d’acquérir une vision globale des médulloblastomes, les équipes de recherche (voir encadré) ont étudié depuis les échantillons tumoraux jusqu’aux données moléculaires en incluant les données cliniques du patient grâce à la construction d’une cohorte unique de médulloblastomes (MB COMICS – voir encadré). Ainsi, à travers l’étude de 384 échantillons de médulloblastomes issus de la cohorte MB COMICS provenant de France, des États-Unis, d’Allemagne et du Canada, et enrichis de cinq niveaux d’information « omiques », les chercheurs ont étudié la plus grande cohorte internationale de ce type à ce jour dans le domaine du cancer pédiatrique. Puis, ils ont utilisé une analyse bio-informatique intégrative inédite capable de croiser l’ensemble des données « omiques » recueillies (génétiques, protéomiques, phosphoprotéomiques1, métabolomiques ou cliniques) afin de mieux comprendre le fonctionnement des cellules tumorales.
Les lipides, carburant et alliés des cellules cancéreuses
Les résultats obtenus mettent en évidence une hétérogénéité métabolique significative des médulloblastomes du groupe 3, en particulier une signature lipidique unique reflétant une composition particulière en graisses dans les cellules. De plus, cette signature est associée à un sous-groupe de tumeurs caractérisé par l’activation de l’oncogène MYC2, connu pour être lié à un très mauvais pronostic.
Les scientifiques ont également découvert dans ces échantillons de médulloblastomes que les acides gras3 sont rapidement stockés dans des gouttelettes lipidiques. Or, celles-ci jouent un rôle clé dans les cellules tumorales : elles protègent les cellules du stress oxydatif mais également d’un type de mort cellulaire appelé ferroptose4, tout en alimentant les mitochondries en énergie, favorisant ainsi la croissance de la tumeur.
« Pour la première fois, une étude sur le cancer démontre que l’oncogène MYC stimule la formation de gouttelettes lipidiques, révélant ainsi une vulnérabilité jusque-là inconnue dans le groupe 3 de médulloblastomes, lesquels sont particulièrement agressifs », explique le Dr Olivier Ayrault, directeur de recherche au CNRS et directeur de l’unité Mécanismes d’oncogenèse des tumeurs de l’enfant (Institut Curie, Inserm) ayant initié et coordonné ces travaux.
Cibler les réserves de graisses des cellules tumorales de médulloblastome, une piste thérapeutique prometteuse
Dans des modèles précliniques, des travaux ont montré que l’inhibition de l’enzyme DGAT1, essentielle à la formation des gouttelettes lipidiques, provoque une mort massive des cellules tumorales. Cette susceptibilité s’explique par l’accumulation de lipides toxiques qui ne peuvent plus être stockés.
« Fait notable : lorsqu’on associe des inhibiteurs de DGAT1 avec une chimiothérapie conventionnelle dans les modèles précliniques de médulloblastomes, on observe une efficacité renforcée du traitement et une amplification de la destruction des cellules tumorales », ajoute le Dr Flavia Bernardi, post-doctorante dans l’équipe menée par le Dr Olivier Ayrault et première auteure de l’article publié dans Cancer Cell.
Ces avancées ouvrent ainsi des perspectives encourageantes pour le développement de traitements combinés ciblant les réserves lipidiques dans les cellules cancéreuses, en particulier chez les patients atteints de médulloblastome du groupe 3 associé au gène MYC.
Notes :
- La phosphoprotéomique correspond à l’étude des niveaux de phosphorylation des protéines dans un échantillon.
- Les oncogènes sont des gènes capables d’induire le développement tumoral.
- Les acides gras sont des molécules de graisse produites par la cellule ou absorbées depuis leur environnement, et utilisées comme source d’énergie ou pour fabriquer des structures cellulaires
- Cette observation fait écho aux découvertes de l’équipe du Dr Raphaël Rodriguez : https://presse.curie.fr/une-nouvelle-classe-de-molecules-contre-les-cellules-cancereuses-refractaires-aux-traitements-conventionnels/?lang=fr
Une collaboration multi-acteurs fructueuse
Initiés et coordonnés par l’équipe CNRS-Inserm « Voies de Signalisation en Neuro-Oncologie Pédiatrique » dirigée à l’Institut Curie par le Dr Olivier Ayrault, directeur de recherche au CNRS et directeur de l’unité Mécanismes d’oncogenèse des tumeurs de l’enfant (Institut Curie, Inserm), cette étude est fondée sur une cohorte internationale : la cohorte MB COMICS qui est co-dirigée par le Dr Olivier Ayrault (Institut Curie) et Dr Christelle Dufour (Gustave Roussy). MB COMICS est le fruit d’une collaboration étroite entre les centres de l’Institut Curie (Pr Franck Bourdeaut et le centre SIREDO pour Soins, Innovation, Recherche, en oncologie de l’Enfant, de l’aDOlescent et de l’adulte jeune de l’Institut Curie), de Gustave Roussy (Dr Christelle Dufour), du service de neurochirurgie pédiatrique de l’Hôpital Necker–Enfants malades (Pr Thomas Blauwblomme et Pr Kévin Beccaria) et du service de neuropathologie du Pole Neuro-Sainte-Anne, GHU-Paris (Pr Pascale Varlet). Soutenue par un accord de consortium signé en 2020, cette initiative s’inscrit pleinement dans la vision de Paris Kids Cancer (PKC). Centre intégré d’excellence en cancérologie pédiatrique d’Île-de-France labellisé par l’INCa en 2023 et dirigé par le Dr Olivier Delattre (Institut Curie), PKC est porté par l’AP-HP, Gustave Roussy et l’Institut Curie. Il a pour ambition de rassembler les équipes franciliennes de recherche et de soins dédiées aux cancers de l’enfant et de l’adolescent autour d’un programme scientifique commun, visant à décrypter les mécanismes de résistance tumorale et à développer de nouvelles stratégies thérapeutiques.
Par ailleurs, cette étude a été menée dans le cadre d’une collaboration ayant impliquée aux États-Unis les équipes du Dr Michael Taylor au Baylor College of Medicine et du Dr Antony Michealraj à l’Université de Pittsburgh ainsi que l’équipe du Dr Jean-Emmanuel Sarry, directeur de recherche Inserm au Centre de recherches en cancérologie de Toulouse (CRCT – Inserm, CNRS, Université de Toulouse). Ces travaux ont également bénéficié du soutien de plusieurs associations.






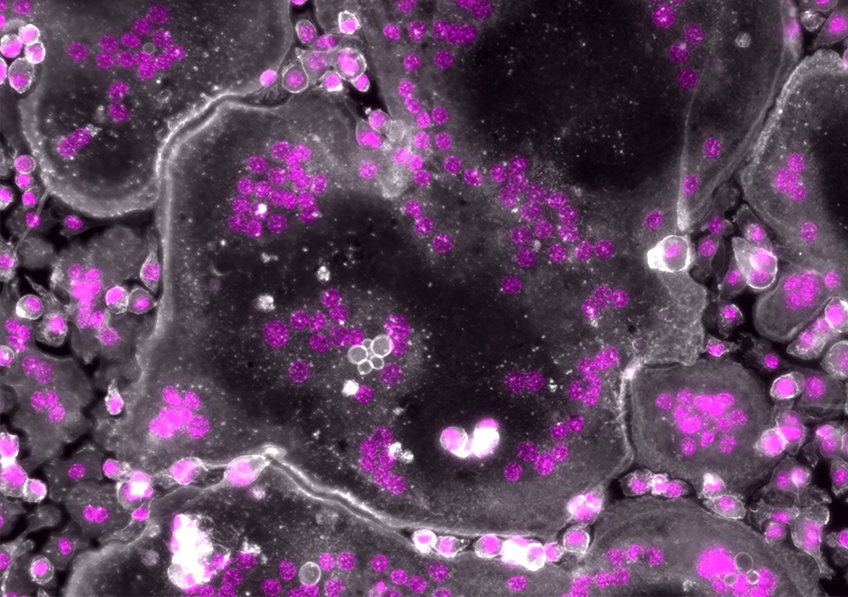
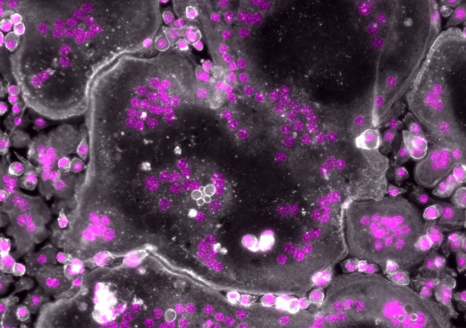 En l’absence de moésine, les ostéoclastes humains présentent des noyaux surnuméraires (en rose). L’actine est représentée en blanc. – Microscopie à fluorescence © Ophélie Dufrançais
En l’absence de moésine, les ostéoclastes humains présentent des noyaux surnuméraires (en rose). L’actine est représentée en blanc. – Microscopie à fluorescence © Ophélie Dufrançais