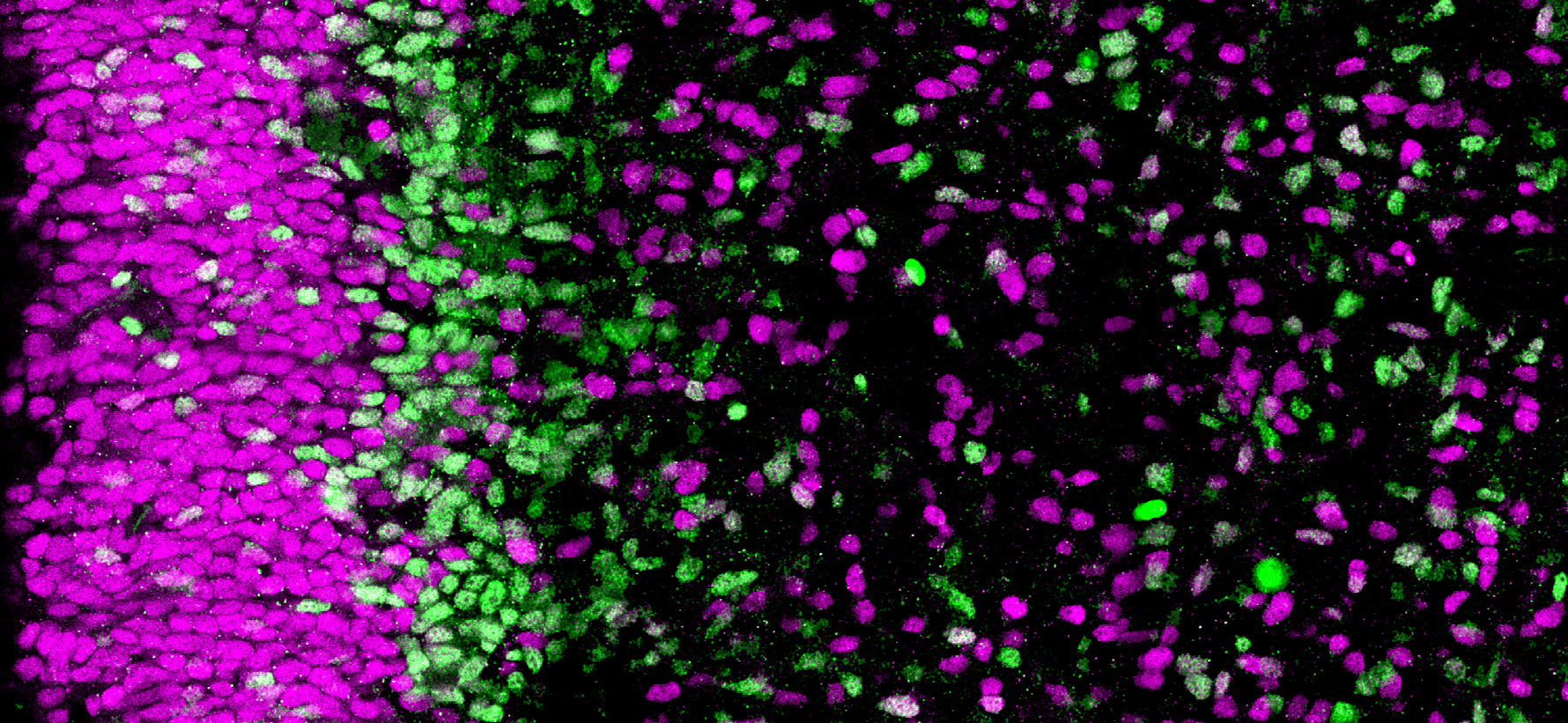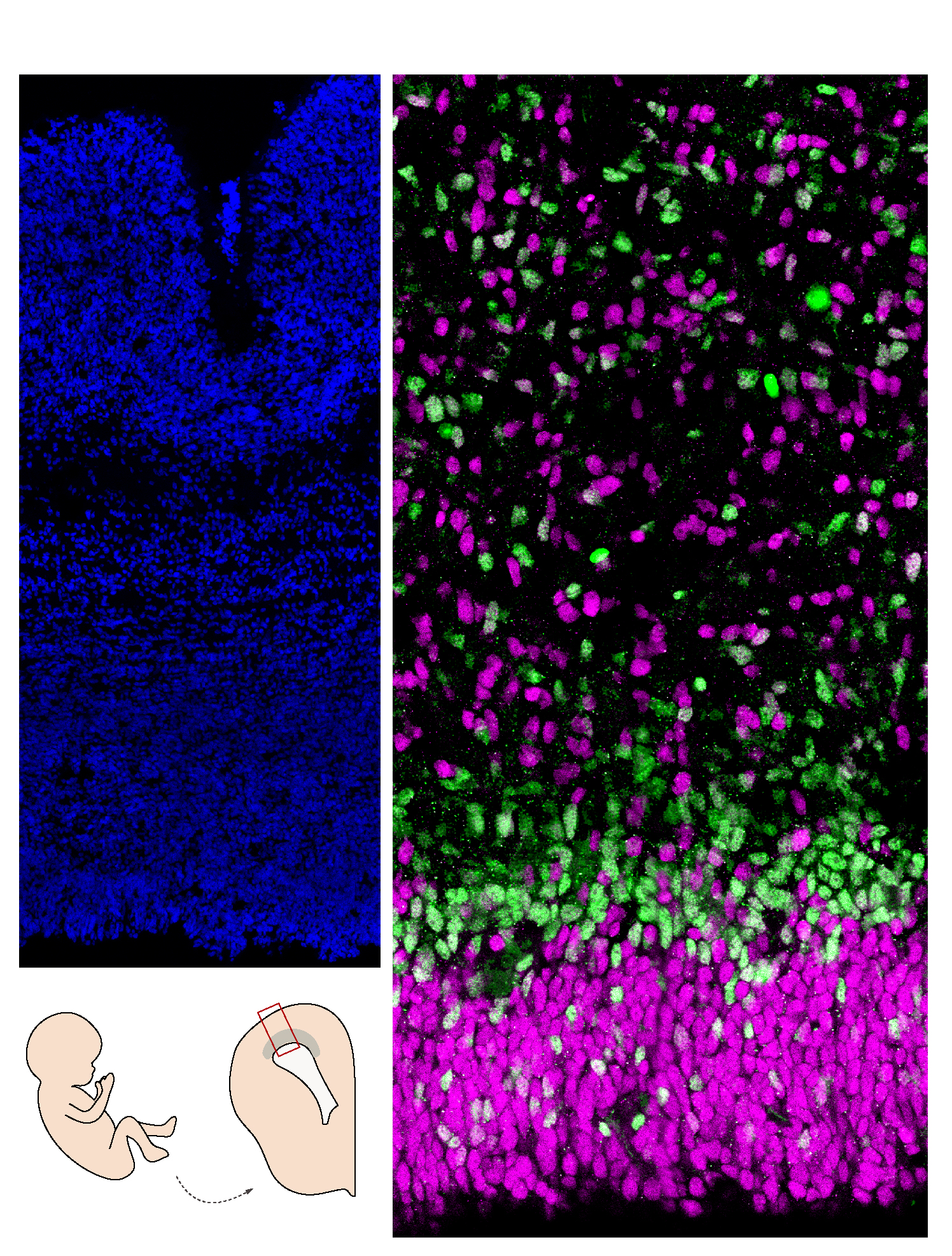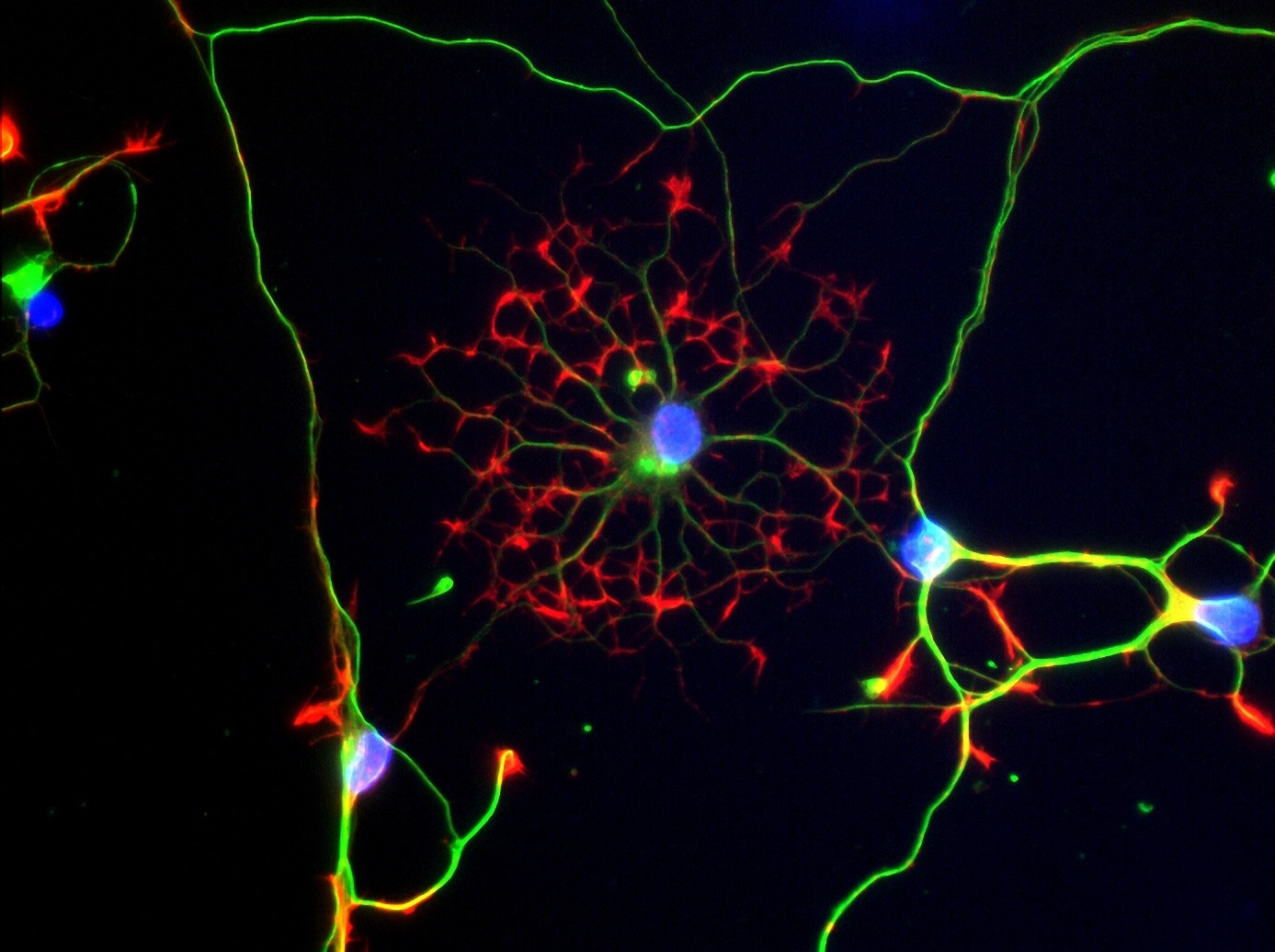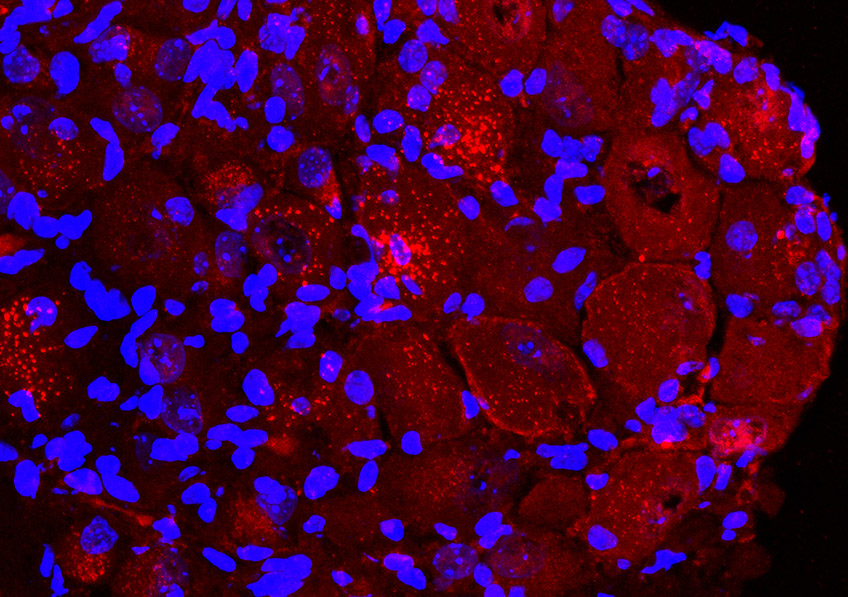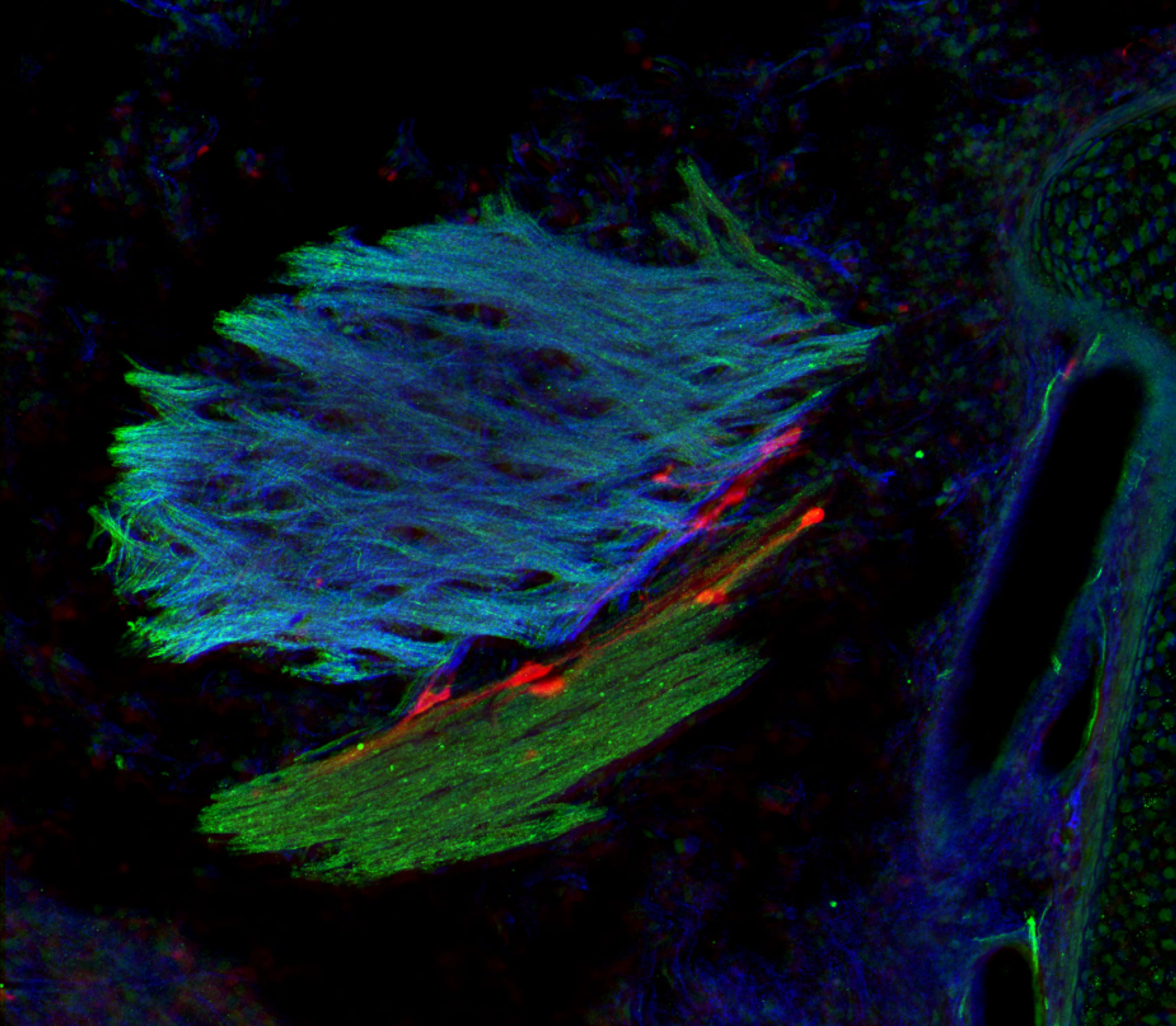
Les neurones à GnRH (cellules rouges) qui naissent dans le nez utilisent les fibres olfactives (marquage vert et bleu) pour migrer dans le cerveau pendant la vie fœtale. ©European Research Council/Agence Nationale de la Recherche Médicale/Métropole Européenne de Lille
Jusqu’à aujourd’hui, il était communément admis que c’était l’accélération de la croissance qui déclenchait la puberté. Or, une équipe de recherche de l’Inserm, du CHU de Lille et de l’Université de Lille, au sein du laboratoire Lille Neuroscience et Cognition, a découvert chez la souris un mécanisme associé au pic de croissance prépubaire et au déclenchement d’une puberté précoce. Ce mécanisme est régulé par les neurones à GnRH, les chefs d’orchestre de la fertilité, via l’expression de leur protéine Nrp1. Ces travaux, publiés dans The EMBO Journal, remettent en question les connaissances sur les déclencheurs de la puberté et ouvrent la voie à l’étude de ce mécanisme chez l’Homme et à son implication possible dans certains cas de puberté précoce.
Il est communément admis qu’un pic de croissance au début de la puberté déclencherait l’activation des neurones à GnRH[1] dans le cerveau et la libération des hormones sexuelles. Au cours du développement embryonnaire, ces neurones à GnRH apparaissent au niveau du nez et migrent vers le cerveau jusqu’à l’hypothalamus. C’est de là qu’ils orchestreront plus tard la fertilité.
Des travaux, menés par le directeur de recherche Inserm Vincent Prévot et son équipe au sein du laboratoire Lille Neuroscience et Cognition (Inserm/CHU de Lille/Université de Lille), viennent questionner ce consensus scientifique en réexaminant le rôle des neurones à GnRH dans le déclenchement de la puberté.
Cette étude fait suite à de précédents travaux dans lesquels Vincent Prévot et son équipe avaient montré qu’une protéine, appelée Nrp1, présente le long des axones reliant le nez au système olfactif du cerveau, rentrait dans la composition des « rails » qui permettent la migration de neurones à GnRH du nez vers le cerveau durant le développement embryonnaire. Or, cette protéine Nrp1 est également exprimée par les neurones à GnRH eux-mêmes. Les chercheurs se sont donc intéressés à son rôle dans la migration et le fonctionnement de ces neurones. Pour cela, ils ont développé un modèle de souris chez qui Nrp1 est inactivée uniquement dans les neurones à GnRH mais reste exprimée ailleurs. Ces neurones ont été marqués par fluorescence pour être observés au cours du temps.
L’équipe de recherche a constaté chez les souris mutées une augmentation de la quantité de neurones à GnRH au niveau du nez qui est associée à un début de migration plus précoce vers le cerveau. Au niveau physiologique, les auteurs ont constaté une prise de poids et une croissance plus rapide des souris mutées par rapport aux animaux contrôles, ainsi que le déclenchement d’une puberté plus précoce.
Ces observations suggèrent que les neurones à GnRH pourraient en réalité contrôler le pic de croissance pré-pubertaire et non l’inverse comme le pensaient les chercheurs jusque-là.
« Nous allons rechercher des connexions et communications entre les neurones à GnRH et les fonctions de régulation de l’appétit et de la croissance pour expliquer ce phénomène, précise Vincent Prévot. C’est la première fois à ma connaissance que l’on attribue à ces neurones à GnRH des fonctions différentes de la reproduction. »
Les chercheurs ont également observé que, chez les souris mutées, les neurones avaient colonisé une zone inhabituelle dans le cerveau, le lobe olfactif – centre de traitement de l’information olfactive –, alors qu’ils se concentrent normalement uniquement dans l’hypothalamus. Cette constatation les a conduits à vérifier si la perception des odeurs – connue pour jouer un rôle dans l’attirance sexuelle – pouvait être modifiée. Ils ont alors observé que de très jeunes souris femelles présentant un défaut de Nrp1 avaient, contrairement à celles du groupe contrôle, une préférence pour les odeurs de souris mâles par rapport aux odeurs de souris du même sexe. La puberté précoce chez ces souris mutées pourrait donc s’accompagner d’une attirance sexuelle également plus précoce.
Reste à vérifier si ces mécanismes sont observables chez l’humain. « Ces résultats suggèrent qu’un pic de croissance survenant très tôt pourrait être associé à une activation précoce des neurones à GnRH. Ce phénomène pourrait, de plus, être associé à certains variants du gène NRP1. Ces résultats ouvrent de nouvelles pistes dans la prévention des risques de puberté précoce chez l’enfant. Nous allons à présent explorer la piste de l’inhibition de l’activité des neurones à GnRH avec des médicaments déjà utilisés en clinique », prévoit Vincent Prévot.
[1] Un groupe de cellules localisées au niveau de l’hypothalamus dans le cerveau sécrètent une hormone appelée GnRH (gonadotropin-releasing hormone) et qui contrôle la puberté et la fertilité. La GnRH stimule en effet la sécrétion des hormones sexuelles LH et FSH qui stimulent à leur tour les gonades. L’acquisition de ces fonctions est un long processus qui démarre par la migration des cellules à GnRH du nez vers le cerveau au moment du développement embryonnaire, puis se poursuit par la maturation et l’activation de ces cellules à la puberté.