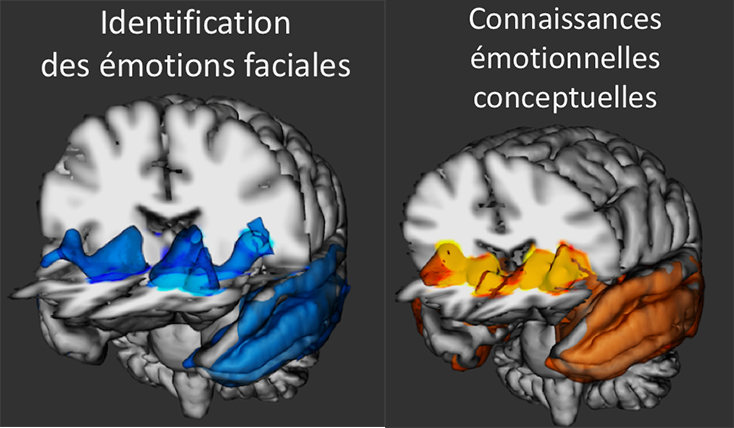
La recherche d’un effet récompense par l’effort physique constituerait un aspect important de la maladie qui serait génétiquement influencée. © Bruno Nascimento sur Unsplash.
Chez les patientes souffrant d’anorexie mentale, la perte de poids par carence alimentaire s’accompagne de fatigue et de diminution des capacités physiques. Pourtant, elles continuent souvent à pratiquer intensément une activité sportive qui participe à l’amaigrissement. Des chercheurs de l’Inserm et de Université de Paris à l’Institut de Psychiatrie et Neurosciences de Paris et au GHU Paris psychiatrie & neurosciences montrent que l’effort physique génère des émotions positives chez les patientes (ce qui était attendu) mais aussi de manière plus étonnante, chez leurs apparentés non malades. Ce n’est toutefois pas le cas chez les sujets contrôles.
La recherche d’un effet récompense par l’effort physique constituerait donc un aspect important de la maladie qui serait génétiquement influencée. Ces travaux publiés dans l’International Journal of Eating Disorders pourraient permettre d’axer la prise en charge des patientes souffrant d’anorexie mentale vers les dépenses caloriques (le sport) plutôt qu’exclusivement vers les carences d’apport (l’alimentation).
L’anorexie mentale est un trouble du comportement alimentaire qui affecte majoritairement les jeunes filles entre 15 et 25 ans. La prévalence de l’anorexie au cours de la vie serait d’un peu plus de 1 % chez les femmes. Philip Gorwood et Laura Di Lodovico à l’Institut de Psychiatrie et Neurosciences de Paris (Inserm/université de Paris) et au GHU Paris psychiatrie & neurosciences tentent depuis des années de mieux comprendre la maladie et d’améliorer la prise en charge.
Leurs travaux se sont notamment intéressés à l’effet récompense associé au fait de ne pas s’alimenter et de perdre du de poids. « Nous savons que l’anorexie mentale s’organise sur un cercle vicieux, où ce qui me fait maigrir est tellement gratifiant dans ce que j’en ressens, que je peux passer outre les dangers que j’arrive pourtant à comprendre. Cette anomalie du processus décisionnel est clairement en lien avec l’effet récompense (le cerveau renvoie des messages valorisant le maintien du trouble). Mais il est compliqué de comprendre comment un manque (la carence alimentaire) peut être en soi un ‘renforçateur’. C’est pourquoi nous nous sommes plutôt penchés sur l’autre versant de la perte de poids, l’activité physique. », explique Philip Gorwood.
En partant de ces interrogations, les scientifiques ont montré dans une précédente étude que l’anorexie mentale est plus associée au plaisir de maigrir qu’à la peur de grossir, et que cet aspect serait génétiquement influencé.
Dans leurs nouveaux travaux, ils poursuivent leurs réflexions sur les critères cliniques de la maladie et sur son héritabilité[1] en s’intéressant à la notion d’exercice physique. « Il s’agit d’une approche atypique car l’effort physique n’est pas considéré comme une manifestation clinique de l’anorexie, alors même que de nombreuses patientes font énormément de sport, notamment pour gérer leur faim et perdre des calories », précise Philip Gorwood.
L’équipe estimait qu’il s’agissait là d’un aspect d’autant plus intéressant à étudier qu’il y a là encore une contradiction : les patientes anorexiques persistent à faire de l’exercice alors même que le fait d’être en sous-poids occasionne une diminution progressive de leurs capacités physiques.
Les patientes, leurs proches, et les autres
Le protocole de cette étude est original car il permet aux chercheurs de se pencher non seulement sur les émotions et les perceptions des patientes à la suite d’un exercice physique standardisé, mais aussi sur celles de membres de leur famille (mères et sœurs notamment). Ainsi, 88 patientes souffrant d’anorexie mentale, 30 de leurs proches non malades et 89 individus « contrôles » sains ont été recrutés dans cette étude. Tous ont été invités à pratiquer un exercice physique standardisé puis à répondre à des questionnaires portant notamment sur leurs émotions après l’effort et sur la perception de leur image corporelle.
Les scientifiques montrent qu’à effort équivalent, les patientes anorexiques rapportent plus d’émotions positives que les contrôles. « Le fait de faire du sport leur envoie un message de renforcement positif qui fait que les patientes poursuivent cette activité en dépit de leur fatigue ou de leur faiblesse. La dépense calorique associée à cette activité physique est un facteur déterminant qui conduit à poursuivre cet effort », explique Philip Gorwood.
Cet aspect ne se retrouvait pas chez les contrôles, mais il était présent chez les proches des patientes. L’étude suggère donc que ce trait est partagé au sein de la famille des personnes atteintes d’anorexie.
L’activité physique est associée à un effet récompense, et celui-ci serait impliqué dans l’héritabilité de la maladie.
Ces résultats ont des conséquences en matière de prise en charge. Ils insistent en effet sur l’importance d’axer une partie des soins sur l’effort physique. L’idée est de travailler avec les patientes pour leur réapprendre à découvrir l’effort physique plaisir (donc modéré) et donc de désapprendre l’effort physique addictif, probablement associé à une finalité de perte de poids. Cet aspect de la prise en charge était déjà considéré comme important par des équipes spécialisées, mais l’étude permet d’apporter des arguments scientifiques concrets pour poursuivre dans cette voie, légitimer cette pratique de soin et en généraliser l’utilisation.
[1] L’héritabilité désigne la part des gènes dans les différences entre individus, c’est-à-dire dans la variance d’un caractère exprimé par un échantillon de sujets (ici l’anorexie).